がん患者に朗報―臨床試験が探しやすくなる

昨年には臨床研究法が成立、しかし・・・
昨年4月に、臨床研究法が成立しています。
同法は、医薬品などの臨床研究のうち、製薬会社などから提供された資金や、国の未承認薬などで行うものを「特定臨床研究」と規定。臨床研究を実施する大学側に対しては、データの不正がないか点検するよう求め、研究実施後も妥当性が検証できるよう、データを長期保管することも求めた。
この法律は、特定の臨床研究の不正をなくするのが目的で成立したのですが、一方で、がん患者にとって臨床試験へのアクセスが難しいという問題があります。
過去のブログでも書いたように(下の「このブログのお薦め記事」参照)、すべての臨床試験が国内の臨床試験情報登録センターに登録されているとは限らないからです。
すべての臨床試験の登録が義務づけられた
3月26日、厚生労働省医薬・生活衛生局医薬品審査管理課は「治験の実施状況の登録について」という課長通知を都道府県宛てに発出しました。これにより、国内で治験を行う場合は、国内の臨床試験情報登録センターに登録されることが義務付けられることになりました。
保護、医療関係者及び国民の治験情報へのアクセスの確保、治験の活性化に資する
ため、治験計画届を届け出た場合には、国内の臨床試験情報登録センター「jRCT (Japan Registry of Clinical Trials)、JapicCTI及び日本医師会臨床試験登録システム」に当該治験に係る情報を登録すること。登録する治験の範囲
治験薬等を用いた臨床試験。ただし、健常人を対象とした第I相試験及び生物学的同等性試験についてはその限りではない。
ただし、jRCT(Japan Registry of Clinical Trials)は、本年4月以降に整備される予定です。
臨床試験についてイは、これまでは「登録することが望ましい」とされていたものが、登録が義務づけられたわけです。
また、米国の『Clinical Trial.gov』などに登録をすれば、国内の機関には登録する必要がなかったのですが、これも
我が国における医療関係者や国民による治験情報へのアクセスの確保の観点及び治験情報の国際的な共有(世界保健機関(WHO)のRegistry Network上のPrimary Registryへの登録)の観点から、日本語及び英語で登録する。
と、日本語での登録が義務づけられました。
がん患者にとっては、臨床試験へのアクセスがしやすくなることで、朗報です。
大学病院医療情報ネットワーク研究センター(通称:UMINセンター)の名がないのが不可解ですが、UMINには、多くのがん患者が求めている治験の情報は少ないからなのでしょうか。
第Ⅰ相試験も探しやすくなる
健常人を対象とした第Ⅰ相試験以外の第Ⅰ相試験が登録を義務づけられたことも重要です。標準治療で効果がなくなったがん患者は、すでに多くの抗がん剤の治療を受けているため、あるいは、「最低でも半年以上の生存が見込まれる」などの条件があるために、末期で藁をも掴みたい患者は、第Ⅱ、第Ⅲ相試験に参加できないことが多いからです。
第Ⅰ相試験は「有効性の検証」が主目的であり、標準治療が無効となった患者さんが、せめてがん研究に貢献したいとの思いで参加することが多いようです。
しかし近年では、分子標的薬の開発が進み、治療が奏効するとみられる患者さんを特定するための遺伝子(バイオマーカー)検査も発達しています。第Ⅰ相臨床試験においても、これまでよりも大きなメリットが期待できるようになりつつあります。
臨床試験の探し方
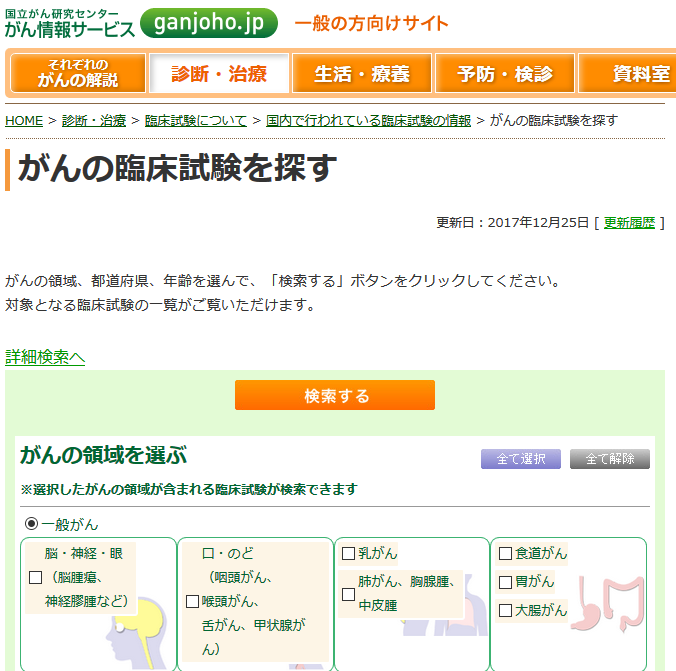
がん患者が、国内の登録センターを横断的に探すのは困難でしょうから、3つのセンターの情報を網羅している「がん情報サービス」の「がんの臨床試験を探す」を使えば良いでしょう。(検索方法によっては他の登録センターが探しやすいこともあります)
jRCT(Japan Registry of Clinical Trials)の情報もいずれ「がんの臨床試験を探す」で検索できるようになると思われます。
臨床研究、臨床試験、治験の区別
これらの区別についてイは、「がん情報サービス」の記事が分かりやすいでしょう。
| Q5 | 「臨床研究」という似た言葉も聞きますが、区別がわかりません |
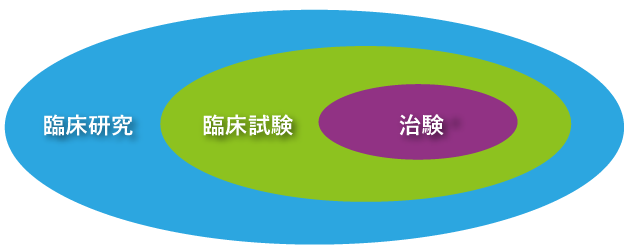
A5図1にあるように、「臨床研究」は、臨床現場でヒトを対象に行われる研究すべてをいい、その中に「臨床試験」が含まれます。臨床研究の中でも、評価したい薬や治療法などを、対象の患者さんに行う研究を臨床試験といいます。
図1 臨床研究の枠組み
| Q6 | 「臨床試験」と「治験」は、違うのですか? |