標準治療が最高の治療法、とは限らない
ーー 目次 --
世の中にはがんに対する様々な代替療法が溢れています。藁をもつかみたいがん患者さんが、これらのインチキ代替療法、悪徳医師に騙される例が後を絶ちません。
それらに警鐘を鳴らす形で、著名な腫瘍内科医の先生たちが、書籍やインターネット上で発信をしております。
もちろんこの主張は正しいことです。私の膵臓がん治療も標準治療以外は受けたことはありませんし、がん患者さんから相談を受ければ、まず真っ先に標準治療を検討すべきだと助言をしております。
しかし、全ての標準治療がしっかりとした臨床試験に基づいてエビデンスを確立した上で承認されているのかと言うと、これは甚だ疑問です。
なかには効果がないどころか、がん患者さんに悪影響を及ぼしかねない標準治療さえ存在します。特に最近増えている早期承認薬は、製薬会社の利益にはなってもがん患者さんの利益にはなっていない薬が多くあります。
上の記事で紹介されているように、早期承認薬は、5年後の確認試験で臨床効果を示す必要があります。しかし、5年以上経って確認試験で臨床効果が実証されたのはわずか43%であったにもかかわらず、63%が通常承認に切り替えられていました。
つまり、早期承認薬のうち27%もが、効果がないにもかかわらず継続して使われているのです。
FDA の迅速承認制度は、がん患者の満たされていない医療ニーズを満たす医薬品として、代替エンドポイントに基づいて早期に承認することのできる制度です。本来は全生存期間(OS) を元にしてエビデンスを確立すべきですが、それでは時間がかかるということで、腫瘍の奏効率などの代理エンドポイントが使われています。
これらの代理エンドポイントを使えば、製薬会社としては販売に至るまでの時間や経費が節約でき、莫大な利益が転がり込んできます。
日本の新薬に関わる行政も、FDAを追ってそのまま承認しているのですから、同じです。
しかも5年以上経って、エビデンスが証明できなくても継続して販売することが可能ということになれば、がん患者さんの願いと命を踏み台にして製薬会社の利益を優先しているというわけです。
抗がん剤を使った時の生存期間の伸び率は、わずか2.1ヶ月
こうしたアメリカでの新抗がん剤承認の実情を暴いたのが『悪いがん治療』です。
私もこのブログでこの書籍を紹介しております。
2002年から2014年に、固形がんに対して承認された薬のデータを承認順に 71 剤を解析した研究によると、生存期間の延び幅は中央値でわずか2.1か月でした。
膵臓がんに承認されている薬であるタルセバ(エルロチニブ)はその代表格として、この本ではしばしば取り上げられています。
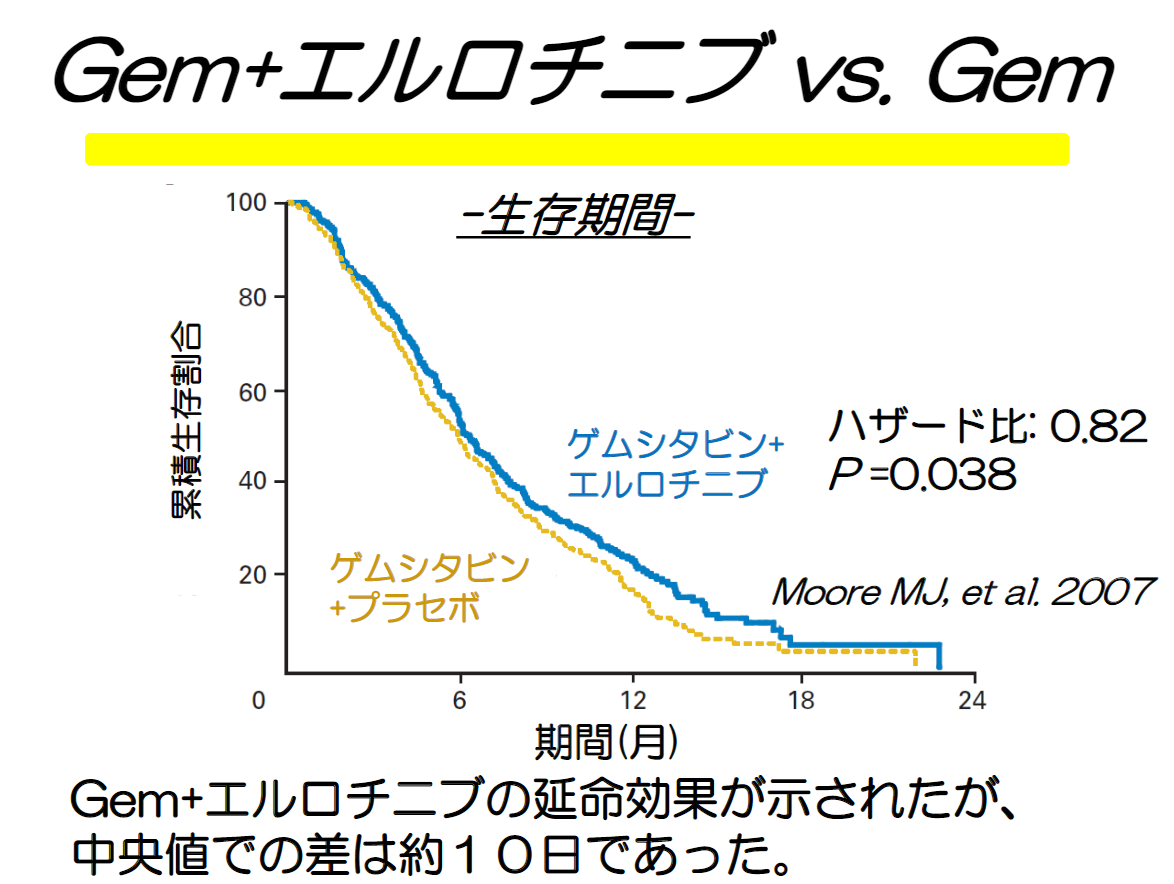
エルロチニブは膵臓がんに対して500人を超える試験で試された。この試験は生存期間が中央値で 10 日から 11 日延びるという統計的に有意な結果を出した。この効果はどう見ても、患者にとって満足できるほどの効果ではない。
『悪いがん治療』より
統計学的に言って、臨床試験に参加する患者が多ければ多いほど統計的有意差は出しやすいのです。要するにごくわずかの差を検出する能力が優れているということができます。
代理エンドポイントで全生存期間(OS)を延ばせる治療とは限らない
奏効率や無増悪生存期間などの代理エンドポイントは、恣意的に選ばれたな基準を超えて小さくなるか大きくなるかを問題にしています。この基準は恣意的に選ばれたものですから、代理エンドポイントが全生存期間(OS)や QOL と一致しないのは当たり前です。
- FDAが6年間に承認した全てのがん治療薬で、66%が代理エンドポイントで承認されていた。
- その約半数が迅速承認であり、代理エンドポイントはすべての迅速承認で使われていた。
- 迅速承認されたがん治療薬では、代理エンドポイントと全生存期間の相関係数が4件報告されている。そしてそれら全て相関は弱かった(R≦0.7)。
膵臓癌のFOLFIRINOX療法で治療後の維持療法として承認されているオラパリブ(リムパーザ)を見てみよう。
BRACA遺伝子変異が陽性である約5%ほどの膵臓がん患者が使うことができるが、「膵癌診療ガイドライン2019」には、推奨するのに反対との意見を述べた委員がいたと書かれている。
- 遠隔転移を有する 膵癌患者に対し、プラセボと比べて無増悪生存期間(PFS)を延長することがPOLO 試験で示された。
- しかし、全生存期間(OS)では統計的な有意差は認められなかった。
- さらに、オラバリブの薬価は、1日あたり20,740円、月に60万円以上と高額
代理エンドポイントを使ってがん治療薬を承認すると、こうした奇怪なことが起きるのです。
「がん医療の闇」佐藤典宏
個別化医療を謳って大々的に持ち上げられているがんゲノム医療ですが、費用のかかる割には効果を上げているとは言えません。がん患者としては期待が大きかっただけに、裏切られた気持ちです。
この本の内容は、佐藤典宏先生が YouTube で「3つの闇」として、分かりやすく解説をしてくださっております。
- 医療費の闇(がん経済毒性)
- エビデンスの闇
- がんゲノム医療の闇
がん治療に関わる日本の医療者として、佐藤先生のように勇気を持った発言のできる方はごく少数です。
がん標準治療が「本当に良い」とはかぎらない深い理由:押川勝太郎
標準治療は教科書。教科書は応用しなければ意味がないし、6割の患者にしか適用ができない。
押川先生のこちらの動画もお勧めですよ。






