プレシジョン・メディシンのまとめ
ーー 目次 --

今の話題はプレシジョン・メディシンでしょう。ざっくりとまとめてみます。
膵臓がんで「もう効く抗がん剤はありません」と言われた時、まだ諦めるのは早いです。京都大学医学部付属病院におけるプレシジョン・メディシンでは、膵がんで、遺伝性乳がん卵巣がん症候群の原因遺伝子であるBRCA2遺伝子に変異が見つかった人については、BRCA2遺伝子変異のあるがんに効くとされるプラチナ系の抗がん剤オキサリプラチンとS-1を投与したところ、肝転移が消え、病状が安定している方がいます。
「プレシジョン・メディシン⑥ 京都大学医学部附属病院などで進む「オンコプライム」を用いた遺伝子診断・治療とは」
日本のプレシジョン・メディシン
これまでも「個別化医療(Personalized Medicine)」という考えはありました。この10年ほどで急激に発達した遺伝子解析技術を使って、個々の患者の遺伝子の特徴や患者の状態に応じた治療法のことですが、費用が高額になり、裕福な患者しかうけられません。全ての患者に個別化医療を提供することは、医療財政的にも不可能です。
それに対して「高精度医療(Precision Medicine)」は、2015年にオバマ前大統領が一般教書演説で取りあげて話題になりましたが、がん患者を特定の患者集団として分類し、その集団ごとの治療法と予防について対応していくものです。個別化医療ほどには費用がかからないといわれています。
SCRUM-Japan
日本でも、2015年2月から、全国200以上の医療機関と15の製薬会社が参加し、臨床試験の大規模プロジェクト「遺伝子スクリーニングネットワーク SCRUM-Japan(スクラム・ジャパン)」が行われています(実施期間は、2017年3月までの予定だったが、4月に新たに製薬会社1社が加わり、2年の延長が決定)。
SCRUM-Japanは、2013年に開始した希少肺がんの遺伝子スクリーニングネットワーク「LC-SCRUM-Japan」と、翌14年に開始した大腸がんの遺伝子スクリーニングネットワーク「GI-SCREEN」が統合してできた、日本初の産学連携全国がんゲノムスクリーニングプロジェクトです。「SCRUM-Japanについて」
SCRUM-Japanには2つのプロジェクト、LC-SCRUM-JapanとGI-SCREENがあります。LCは肺、GIは消化器です。膵臓がん患者はGI-SCREENプロジェクトが対象となります。
これらのプロジェクトでは、
- 遺伝子検査には数十万円から100万円ほどの費用がかかるが、このプロジェクトで患者負担の費用はない
- 治療につながる遺伝子異常が見つかる割合は50%ほど。
- さらに適応外の薬も含めて薬事承認されている薬がある割合は30%
- 適応となる治験が走っているとは限らない
- 幸運にして治験が走っていても参加する条件は厳しい
- 結局、新しい薬を投与できる患者は全体の5~10%程度
と思われます。
京都大学医学部付属病院の例でも、治療ができなかった理由は、検査の結果を待っている間に全身状態が悪化した人が3分の1、海外で承認された薬や治験中の薬はあるけれども、まだ開発中で、日本では治験が走っていない、あるいは、治験が終わってしまって使えない人が半分以上でした。
SCRUM-Japanへの、患者さんの参加方法はこちらです。
この検査を受けることによって、保険診療による薬がなくなった患者さんでも、がんの治療薬につながるような情報が得られる可能性が残されているということです。
遺伝子検査の結果、例えばFGFR遺伝子に異常が見つかったとしたら、「関連試験」のページで治験の実施施設などの情報が得られます。

自由診療では
SCRUM-Japanは臨床試験なので費用は企業が負担しますが、参加条件が限られています。自由診療で、網羅的ながん遺伝子検査を実施している医療機関があります。
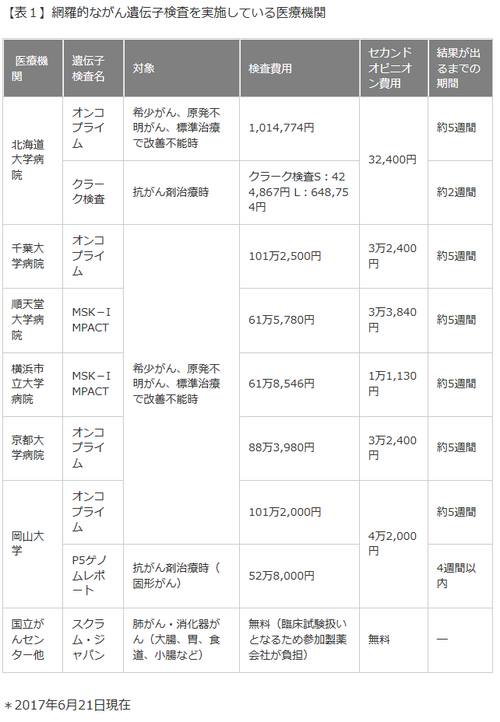
遺伝子検査費用も高額ですが、検査結果を受けておこなう治療も「混合診療」となるため全て自由診療扱いとなり、健康保険は使えません。タイミングよく臨床研究や治験に参加できなければ、自由診療扱いとなります。まぁ、貧乏人には縁のない情報です。
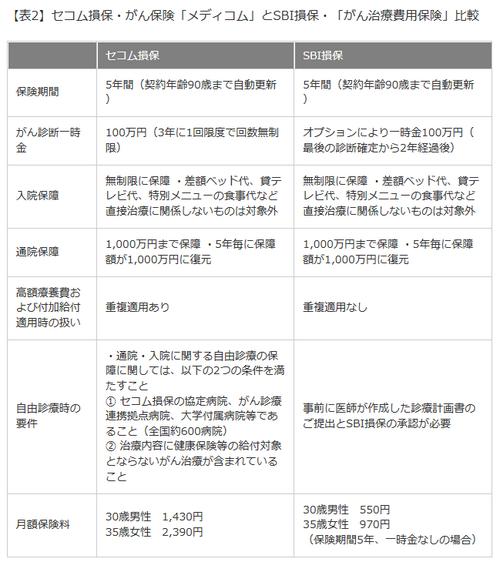
民間保険も使えませんが、がん保険の中には、先進医療や自由診療も含め、実際にかかった費用を補償する「実損てん補タイプ」の商品があります。このタイプの代表格がセコム損保のがん保険「メディコム」とSBI損保の「がん治療費用保険」です。これらに加入していれば費用を補填できるかもしれません。
TOP-GEAR(トップギア)プロジェクト
以下『国立がん研究センター中央病院が進める「TOP-GEARプロジェクト」とは』からの抜粋。
TOP-GEARプロジェクトは、次世代シークエンサー(NGS)を用いた臨床研究です。NGSを用いたクリニカルシーケンスを全国に普及させるための、ロールモデルを作るのが目的です。
検査会社のシスメックス社と共同開発した「NCCオンコパネル」を用いて、114種類の遺伝子異常の有無を院内で解析します。対象は固形がんで、担当医がNGSを使った遺伝子検査が有益と判断した1歳以上の患者さんです。
多くの遺伝子を一度に解析する遺伝子検査である「クリニカルシークエンス」を普及させるためには、ニーズや有益性、必要な人材や設備の把握、どこに課題があるかを抽出するのがプロジェクトの大きな目的です。必ずしも患者の治療を優先的に考えているわけではないのです。
対象は、国立がん研究センター中央病院に来院でき、がん薬物療法ができる状態の患者さんに限定されます。別の病院で治療をしている場合は、担当医に相談して国立がん研究センター中央病院に紹介状を書いてもらい、受診するという流れになります。
研究費で運営しているので、遺伝子解析を受けるための費用については患者の自己負担はありません。それに伴う担当医の診察や血液検査、がんの治療は基本的には保険診療です。しかし、遺伝子解析をして結果を出たところで、見つかった遺伝子異常にぴったり合う薬がまだまだ少ないことです。その遺伝子異常を対象にした薬が見つかったとしても、多くは、まだ有効性や安全性が確定していない開発段階にある治験薬です。
遺伝子解析受託会社が設立される
中村祐輔:シカゴ大教授が科学技術顧問となって、川崎市に「キャンサー・プレシジョン・メディシン」が設立される。
医療機関から患者のがん細胞の遺伝子解析を受託して、最適な治療薬を探すための検査を行う。またがん患者の血液などから、がん細胞由来のDNAを検出する「リキッドバイオプシー」と呼ばれる血液・唾液・尿を採取する手法を用い、レントゲンやCTなどの画像に映る前の段階でがん細胞を発見。遺伝子の塩基配列を同時並行的に読み出せる次世代シーケンサーを駆使して、高速に遺伝子情報を解析する。これによってがんを早期に診断し、分子標的薬が効くタイプの選別などを行うことが可能になる。
科学技術顧問として参画するがん遺伝学の権威、米シカゴ大の中村祐輔教授によると、リキッドバイオプシーは従来の画像検査より6~9カ月早く、がん細胞を見つけられるとのデータがある。
米国で膵臓がんの遺伝子検査にリキッドバイオプシーを採用
リキッドバイオプシーを使うことにより膵臓がんの遺伝子変異を診断できることから、治療薬に耐性ができたときに、腫瘍の分子プロファイリングを通して、新しい治療薬を選択することができるようになる。例えば、腫瘍の遺伝子変異をターゲットにした分子標的薬が治療中に次第に効かなくなる場合、腫瘍が新たな遺伝子変異を通して耐性を獲得していることが考えられる。普通は再生検をしなければならないが、特に難治性がん患者の病態、病状の進み具体では、再生検が困難になることが多い。しかし、血液で遺伝子変異を検出することができれば、患者に負担をかけることなく腫瘍の新しい遺伝子変異に対応した医薬品を選択することが可能となる。
中村祐輔氏の考える次世代がん治療
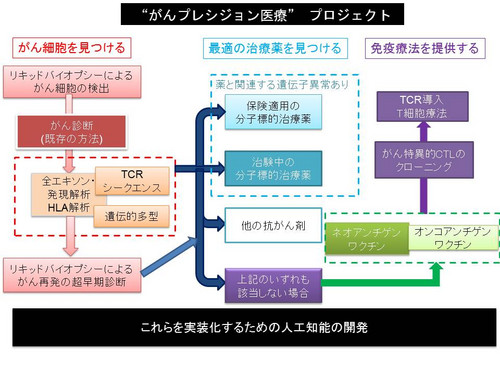
リキッドバイオプシー、遺伝子解析、がんワクチンなどを人工知能の助けを借りて網羅的にがん治療の応用する。(「中村祐輔のシカゴ便り」より)
夢の治療法ではない
プレシジョン・メディシンは決して夢の治療法ではありません。効果のある抗がん剤を見つけても、所詮は延命治療に過ぎません。腫瘍が都合良く消えてくれるわけではないのです。
また、米国と日本における新薬開発の臨床試験の数が圧倒的に違います。遺伝子異常が見つかっても、その治療薬の治験へアクセスできない。個人輸入で未承認薬を使うには年間数千万円が必要になり、うっかり延命したら破産してしまう。再発の恐怖や副作用による休職の恐れはついて回る。
国内での新薬の開発と治験の数を圧倒的に増やさないかぎり、患者の受ける恩恵は限られたものにならざるを得ないでしょう。
がん治療の進歩はすばらしいが、私なら、数千万円かけてわずか数ヵ月程度の延命効果を得るだけなら、このような治療法は選ばずに(ない袖は振れないし)、今の時間を大切に、有意義に過ごす方を選ぶよな。