リムパーザが希少疾病用医薬品として承認される
本ページはプロモーションが含まれています。
YouTubeでも発信しています。
希少疾病用医薬品の承認を取得
アストラゼネカ社のプレスリリースによれば、

とのことです。
これによって日本での承認へ一歩を進めることになります。
米国では昨年2019年12月にすでに承認されており、欧州でも認証の手続きが進んでいると言われています。
希少疾病用医薬品等の指定とは
- 対象患者数が本邦において5万人未満であること
- 医療上特にその必要性が高いもの
が希少疾病用医薬品として承認される条件ですが、これが直ちに製造販売承認になるわけではありません。
しかし、他の医薬品に優先して承認審査が行われて、迅速承認への道がひらけます。
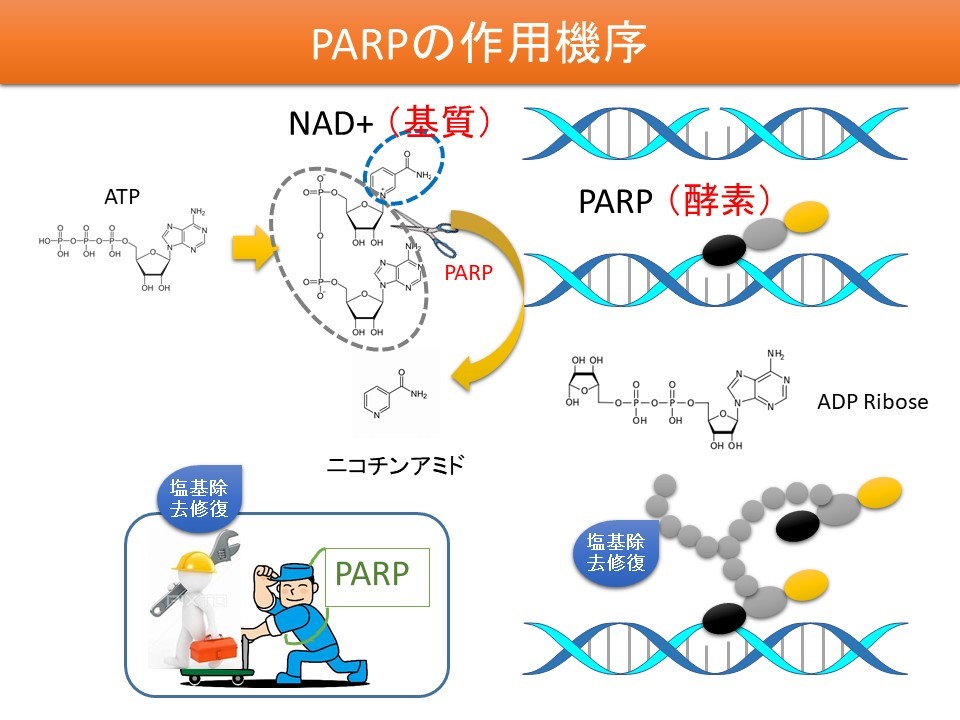
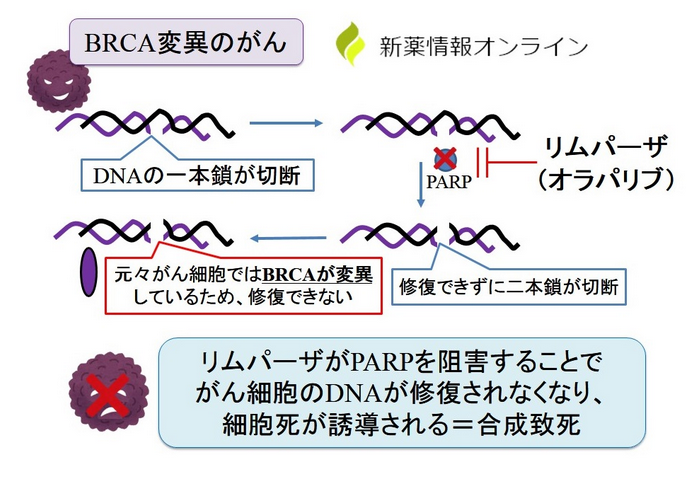
リムパーザの機序
- 細胞のDNA損傷には一本鎖切断と二本鎖切断があり、それぞれを修復する因子にはPARPとBRCAがある
- PARPはDNAの一本鎖が切断されているときに修復する
- BRCAはDNAの二本鎖が切断されているときに修復する
- BRCA遺伝子変異がある患者のがん細胞では、二本鎖切断の修復はできないので、一本鎖修復を阻害する薬剤(PARP阻害薬)でがん細胞は死滅する
- 正常細胞はBRCAによって修復されるので影響は受けない


転移を有する膵臓がん患者でBRCA遺伝子変異のある割合は、4~7%と言われています。
POLO試験の概要
POLO試験の内容は、昨年の日経メディカルに、杏林大学医学部の古瀬純司先生が詳しく書かれています。
古瀬先生には、リムパーザも含めて膵臓がんの遺伝子治療の動向を講演して頂く予定でしたが、新型コロナウイルスのために中止になっています。いずれ次の機会にはぜひお招きしたいと考えています。
- POLO試験の目的
転移を有する膵癌で、生殖細胞系列のBRCA1/2遺伝子変異がある患者において、プラチナ製剤ベースの1次治療後の維持療法として、PARP阻害薬オラパリブの有効性を評価することでした - 転移を有する膵癌患者の4%から7%に生殖細胞系列のBRCA遺伝子変異がある
- プラチナ製剤ベースの1次治療(FOLFIRINOX)後の維持療法としてプラセボ群と比較
- プラセボ群の無増悪生存期間(PFS)の中央値が3.8ヵ月であったのに対し、リムパーザ投与群では7.4ヵ月
- OS(全生存期間中央値)には有意差なし
これがそのPFSの生存率曲線です。

実際に使われる場合の問題点
実臨床で使われるためには、いくつかの問題があります。
- 白金製剤ベース(FOLFIRINOXのこと)の一次治療を行っている患者が対象
- FOLFIRINOXからリムパーザへの切替のタイミングをどう判断するのか
- 遺伝子カウンセリングの体制をどう整えるか
BRCA遺伝子陽性は、本人だけでなく家族にも関わる。娘さんも陽性の可能性があり、乳がんや卵巣がんのリスクが高くなる。 - アブラキサン+ジェムザールを投与されている膵癌患者が6割いるが、これらの患者はBRCA遺伝子変異が陽性であってもリムパーザの恩恵を受けることができない
- 一次治療の前、つまり膵癌が見つかった時点でBRCA遺伝子検査を受けて、治療薬を決定するべきとなるが、全員に対して遺伝子検査ができるのだろうか
など、いくつか問題点がありますが、早い承認で膵臓がん患者の選択肢が増えてほしいものです。