タルセバ承認へ。OCV-101 第Ⅱ相試験 国立がん研究センター東病院
タルセバが6月から承認されるようです。
厚生労働省の薬食審医薬品第二部会は5月30日、新薬など9成分を審議し、承認を了承した。中外製薬の抗がん剤タルセバへの膵がんの適応追加、HPVに起因する子宮頸がんの予防ワクチンとしては2番目になるMSDのガーダシルなどが承認されることになった。
タルセバについては、専門の医師の指示の下で使用し、すべてのケースについて経過を調査をすることを条件に承認してもよいという意見をまとめました。
承認が了承されたのは次のとおり。
【審議品目】
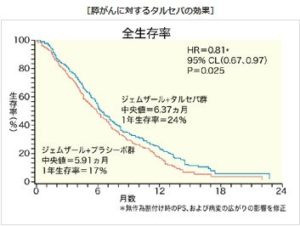
▽タルセバ錠25mg、同100mg(一般名:エルロチニブ塩酸塩、中外製薬):「治癒切除不能な膵がん」の効能・効果を追加とする新効能・新用量医薬品。再審査期間は残余期間(平成27年10月18日)。
膵がん適応では海外76カ国・地域で承認済み。ゲムシタビンと併用。この適応は、厚労省の「医療上の必要性の高い未承認薬・適応外薬検討会議」(未承認薬検討会議)で開発要請されていた。
国立がん研究センター東病院の「治験事務局」のページに、OCV-101 第Ⅲ相試験が新たに掲載されています。「膵がん(6)」と書かれた項目です。切除不能・再発膵がんの患者で、ゲムシタビンとの併用試験です。以前からも実施していたはずだと思うのですが、新たな募集なのか詳細は分かりません。関心のある方は直接お問い合わせください。
(1) 対象となるがん:
切除不能進行・再発膵癌
(2) 使用される新薬(治験薬):
OCV-101(注射剤:ペプチドワクチン)
(3) 実施方法(治験のデザイン):
第 II 相試験
試験治療:OCV-101(皮下注射)+ゲムシタビン(注射)
(4) 治験に参加いただける患者さんの身体状況(患者選択基準):
以下のすべてに該当する方が対象となります。
1. 病理学的に腺癌又は腺扁平上皮癌であることが確認されている浸潤性膵管癌である
2. 切除不能または再発膵癌である
3. 膵癌に対して、切除術以外の治療を行っていない
4. ヒト白血球抗原HLA-A*2402を有する
5. 20歳以上80歳以下
6. 全身状態(Performance Status:ECOG)が0-1
7. 各種臓器機能が保たれている
8. 文書による同意が得られる
※ 上記の患者選択基準は概要であり、上記に該当していてもこの治験に参加できないことがありますので、ご了承ください。
(5) 治験責任医師
池田 公史
○この治験に関する問い合わせ先:
国立がん研究センター東病院 治験事務局
治験問い合せ担当(病院代表:04-7133-1111/内線4047)