光免疫療法、先駆け指定に

光免疫療法
光免疫療法薬が厚生労働省の「先駆け審査指定制度」対象として指定されましたね。
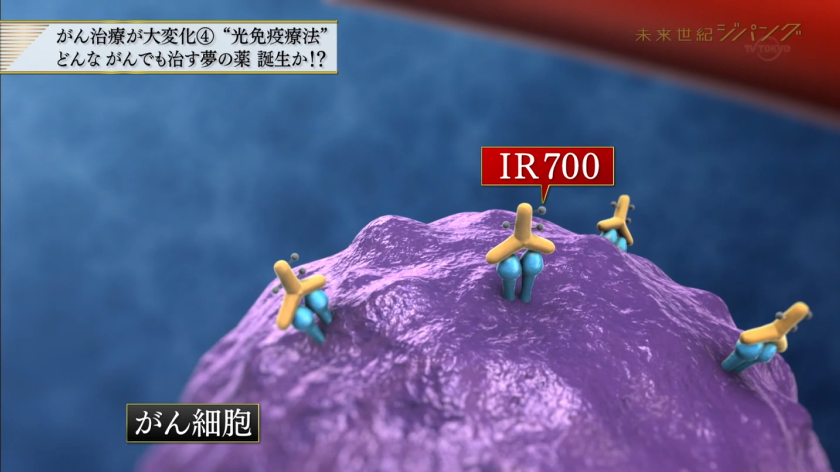
光免疫療法製剤ASP-1929は、抗EGFR抗体セツキシマブに、レーザー装置(PIT690)による非熱性赤色光(690 nm)で活性化されて物理的に細胞膜を破壊する色素IR700を結合させた製剤。申請者は楽天メディカルジャパンで、フェーズ3試験を実施中。
光免疫療法の特性上、薬剤と近赤外線照射装置とあわせて指定です。
「先駆け審査指定制度」は、対象疾患の重篤性など、一定の要件を満たす画期的な新薬などについて、開発の早期段階から対象品目に指定し、薬事承認に関する相談・審査で優先的な取扱いをすることで、承認審査の期間を短縮することを目的としたものです。
通常の新医薬品、新医療機器の場合、12か月を目標に承認審査を行っているが、この制度の指定を受けた品目については、承認審査期間の目標が半分の6か月になります。
世界に先駆けて、日本での承認申請の見通しです。三木谷さん、頑張っていますね。
遅くとも今年中には、頭頸部がんで保険承認されるでしょう。膵臓がんへの適用も急いで欲しいものです。
腫瘍溶解性ウイルス
他にも、切除不能、化学療法不耐容または抵抗性の局所進行食道がんに対して、腫瘍溶解性アデノウイルス薬が含まれています。
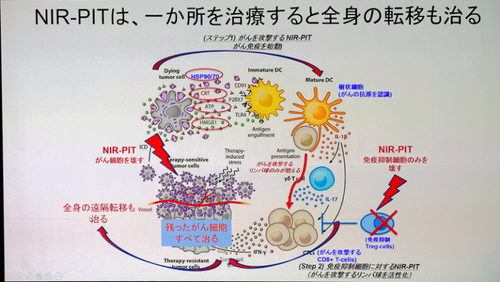
正常細胞で内では増殖せず、がん細胞中で特異的に増殖し、直接細胞を破壊する新規作用機序があるとされています。破壊されたがん細胞の断片を抗原提示細胞(マクロファージや樹状細胞)が認識し、がんに対する免疫が活性化されるともいわれています。
国内での2つの臨床研究・臨床試験(計17例)が実施され、食道局所完全奏効率70.6%と、高い有効性を示唆する結果が得られています。
「膵癌診療ガイドライン 2016年版」では、腫瘍溶解性ウイルス治療も免疫療法のひとつとして触れられていますね。
DNA検査キット
膵臓がん関連もありますよ。
DNA チップによる膵臓・胆道がん検査キット MI-004(仮称)
血清中のマイクロ RNA の発現量の組み合わせを数値化し、膵臓癌・胆道癌の診断フローに用いる検査システムは、世界的にも実用化された事例がなく、画期性が高い。
開発の過程において健康成人と膵臓癌・胆道癌患者を感度80%、特異度 80%で鑑別するアルゴリズム及び閾値が得られている。また、初期の膵臓癌患者において、既存の腫瘍マーカー
である CA19-9 と比較して感度が高いことが示唆されている。
これらに加え、従前の腫瘍マーカー検査とは異なるプロファイルに基づくことも勘案すると、膵臓癌・胆道癌が疑われ精密検査が必要とされる患者の選択に寄与し、治療成績の向上に資す
ることが期待できる。