タルセバの膵臓がん関連情報まとめ (2)
●FDA承認時のデータ(HTML、PPT)
2005年11月にアメリカで膵臓がんに適用承認されたときのメーカー申請データなどが閲覧できる。
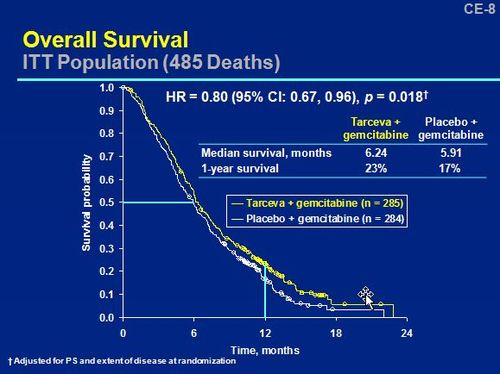
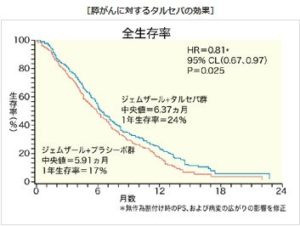
タルセバ群の生存期間中央値が、前回に載せた図では6.37ヶ月、上の図では6.24ヶ月となっている。これは前回の図が「無作為割り付け時のPS、及び病変の広がりを修正」したため、0.13ヶ月長くなっている。グラフ上の丸印は打ちきり例である。タルセバは平均して9.9日の延命効果があるということになる。半数の患者が6ヶ月で亡くなり、長くても2年弱。これはブラセボ群とて同じである。Journal of Clinical Oncologyのabstractはこちらに。
●タルセバの薬事・食品衛生審議会医薬品第二部会議事録
タルセバがすい臓がんに適用承認された5月30日の議事録はまだ公開されていないが、こちらにアップされるはずである。公開された時点で書き足すことにする。公開されました。
ここでは非小細胞肺がんへの承認時の議事録・審査情報を以下で見てみる。
【以下、非小細胞肺がんに関するもの】
●タルセバの添付文書(医薬品医療機器総合機構)
タルセバの非小細胞肺がんに関する添付文書である。患者が詠んでおくべきは赤いフォントの「警告」欄、「禁忌」「重要な副作用」である。4.5%が間質性肺炎になる。また、グレープフルーツ、セイヨウオトギリソウ、セント・ジョーンズ・ワートなどの代替療法にも注意する。
●医療用医薬品の承認審査情報(医薬品医療機器総合機構)
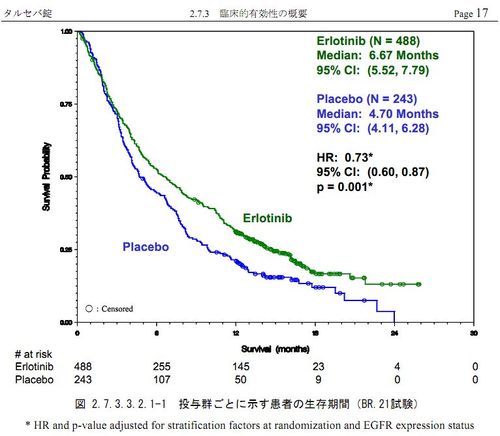
非小細胞肺がんについての承認審査情報がこちらから閲覧できる。「医療用医薬品の承認審査情報(検索ページ)」から、「販売名または一般名」に「タルセバ」または「エルロチニブ」を入れて検索すれば良い。専門用語が多くて理解しづらいが、副作用と生存率が分かれば良い。申請資料概要の「表示」ボタンをクリックして「6.臨床に関する概括評価」の「2」をクリックすれば副作用の詳細が表示される。「10.臨床概要」「4」には生存率曲線が載っている。国内臨床試験結果の生存率曲線は下のようになっている。
●同じ検索結果から「審査報告書」を見る
124ページもあるPDFファイルだから、必要な箇所だけを探してみる。P.52~53に国内臨床試験の結果があるが、第Ⅱ相試験の論文は公表されていないと書かれている。それで海外で実施された臨床試験を見ると、P.55から第Ⅲ相試験が(9)(10)(11)の3つある。上の図は(9)のものであり、New England Journal Medicine 2005;353:123に掲載されたものだと分かる。
他の二つ(10)(11)の臨床試験ともに、
主要評価項目である OSについて、 本薬併用群及び化学療法単独群における MSTは、 各々301日(95%CI [274, 315日])及び 309日(95%CI [282, 343日])であり、化学療法単独群に対して本薬併用群の延長は認められなかった(HR 1.06、p=0.4883、log-rank 検定) 。
主要評価項目であるOSについて、 本薬併用群及び化学療法群のMSTは各々324日 (95%CI [288, 381日])及び 319日(95%CI [285, 344日])であり、化学療法群に対して本薬併用群の延長は認められなかった(HR 0.995、p=0.9517、log-rank検定) 。
と書かれているが、これらの図は載っていない。主要評価項目であるOS(全生存期間)のMST(生存期間中央値)に差がない抗がん剤がなぜ承認されるのか? Ⅲ相試験の論文の結果では1:2である。症例数も否定的な論文の方が多い。結果の良いものだけを採用して承認しているのではないかという疑問が残る。
●厚生労働省:H19年7月25日薬事・食品衛生審議会医薬品第二部会議事録
上の私の疑問が審議会ではどう扱われているかを探してみた。
医薬品医療機器総合機構:海外第III相試験のうち、一つの臨床試験結果からは、標準的な癌化学療法が無効であった患者に本剤を単剤で用いた場合に、プラセボ投与群と比較して全生存期間の延長が認められました。一方、他の二つの海外第III相試験では、標準的な化学療法への本剤の併用が、全生存期間を指標として検討されましたが、いずれの試験結果においても、本剤の上乗せ効果は認められませんでしたので、機構はこの点が明確となるような効能・効果を設定いたしました。
とだけで、その後の審議でもこれには一切触れていない。「この点が明確となるような効能・効果を設定」とはどういうものか、素人には分からない。あとはEGFRがどうのイレッサとの関連で患者確認カードの扱いがどうのとかの議論である。患者がこの薬剤を必要としており、生存期間の延長という結果が、一つの試験だけでもあるから承認しよう、こういう論理のようだ。
藤原康弘 国立がんセンター中央病院臨床検査部長は次のように発言しているが、突っ込みが足りない。New England Journal of Medicineのペーパーでは信用できないといっているのだが・・・。
もう一点は、この審査報告書はNew England Journal of Medicineの公表論文からのデータで、実際にファイナルスタディレポートのような、企業が解析した結果でどのように記載されているのか、不明なところも気になります。というのは、後半、いろいろ審査報告書を見ましたが、QOL評価などもNew England Journal of Medicineのペーパーでは、QOLはポジティブとたしか出ていたと記憶するのですが、興味を持ってFDAの審査報告書の方を見ると、実際に企業がFDAに提出している資料ではQOLの差がなかったり、公表論文と実際のGCP等を踏まえた申請資料との齟齬があって、必ずしも闇雲に公表論文のデータだけを信頼するのも危険なところがあるという印象を持ちました。
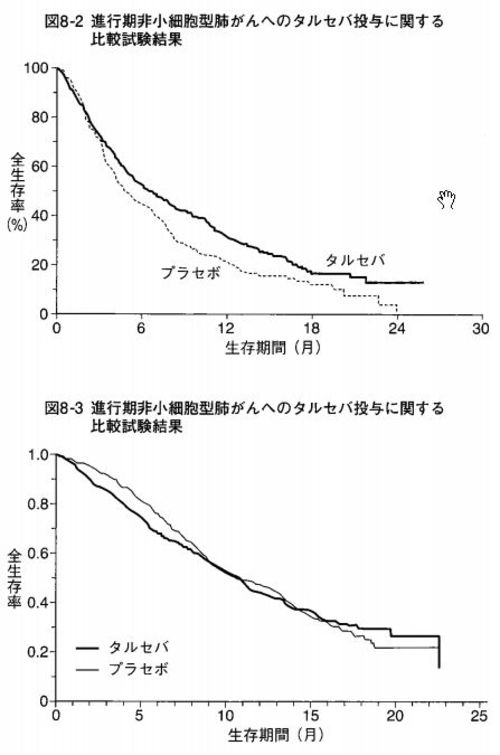
これについては近藤誠氏が最近出版した『抗がん剤は効かない』で触れていて、(11)の論文の生存率曲線も載せて比較している。図8-2はこのページで先に載せたものと同じであり、図8-3が(11)の原論文に載せられている図である。
ところで、図8-2の論文と、図8-3の論文は、雑誌掲載時期がほぼ一緒です。試験結果の信頼性から判断すると、後者のほうが超一流雑誌に掲載されるのがふさわしい。それなのになぜ図8-2のような、いかがわしい内容の論文が超一流雑誌に掲載されるのか。ここには、医学界を取りまく深刻な状況があります。「パブリケーション・バイアス」(出版バイアス)の問題です。
こうして自分で調べてみると、近藤氏の指摘の方がより説得力があるように思う。ブログでは近藤氏を批判したり賛同したり、いろいろであるが、彼の主張に全面的賛成であるはずがない。私の判断に照らして、彼が正しいときには正しいと書いているつもりである。
FDAの図とその下の論文(9)の図を比較してみれば、非小細胞肺がんの場合よりも膵臓がんでは効果がより限定的に思える。図8-3を見れば、初期に亡くなる患者は、返ってタルセバで命を縮めている可能性がある。この図を機構が審査資料に載せれば、もしかすると承認されなかったかもしれない。
膵臓がんへの国内承認でも「専門の医師の指示の下で使用し、すべてのケースについて経過を調査をすること」を条件に承認してもよいとしたのであるが、要するに承認されたとはいえ、臨床試験が延長されたと考えた方が無難である。膵臓がん患者が保健で使うことができる抗がん剤が増えたことを単純に歓迎すれば良いのかも知れないし、この薬で延命する患者もいるには違いない。しかし、患者が延命効果を実感することはできないだろう。国内審査のデータを待つまでもなく、効果はほとんど期待できないのに高価な抗がん剤だから、昨年12月23日のブログでも書いたように、私はこの抗がん剤を使う気にはなれない。
治療戦略の参考にしていただき、自分の価値観・人生観に照らして判断していただきたい。