『ハイパーサーミアはどのようなメカニズムで癌治療に効くのか?特に膵臓癌に対する治療実績』
ーー 目次 --
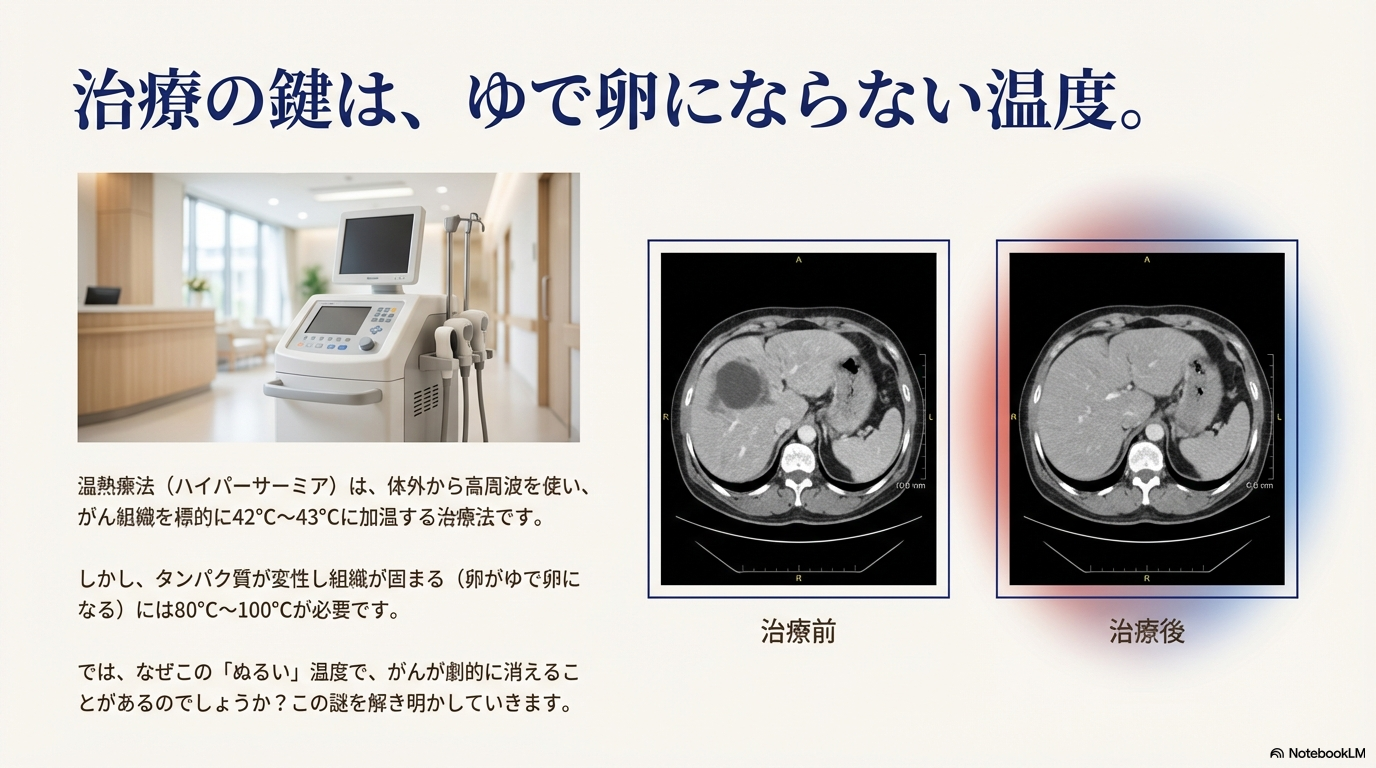
11月29日(土)に開催された「膵臓がん患者と家族の集い」における講演『ハイパーサーミアは、どのようなメカニズムで癌治療に効くのか ― 特に膵臓癌に対する治療成績』の動画が公開されています。
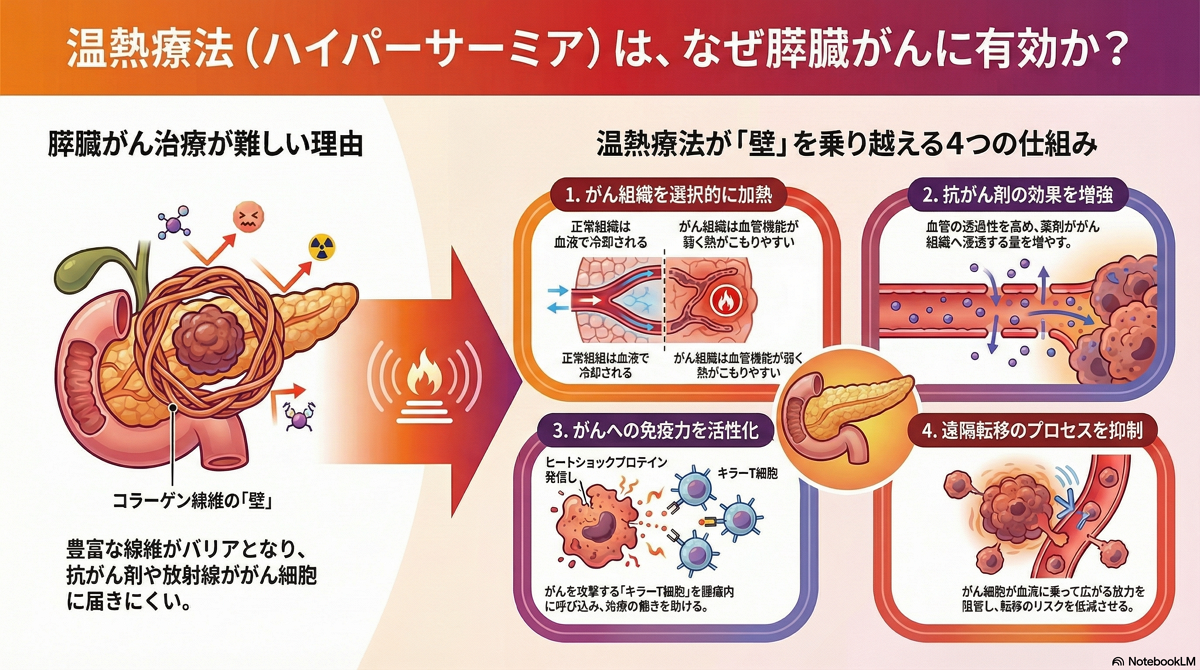
難治性のがんである膵臓がんの患者では、ハイパーサーミアに関心を持つ方が多い。
本講演は、日本ハイパーサーミア学会理事長であり、京都先端科学大学 健康医療学部教授の古倉 聡先生によるものです。
1時間の講演を、要点を中心に文字起こしし、生成AI「NotebookLM」を使ってスライドにまとめました。



ハイパーサーミア(温熱療法)の作用機序と臨床効果
エグゼクティブサマリー
本ブリーフィングは、京都先端科学大学の小倉理教授(日本ハイパーサーミア学会理事長)による講演に基づき、がん治療法であるハイパーサーミア(温熱療法)の作用機序、臨床的有効性、特に膵臓がん治療における重要性をまとめたものである。ハイパーサーミアは、高周波を用いてがん組織を選択的に42.5℃以上に加温する治療法であり、その有効性は5つの主要な生物学的メカニズムに支えられている。
- がん組織の熱脆弱性: がん組織は血管機能が脆弱で血流による冷却が起こりにくいため、正常組織に比べ選択的に加温されやすい。42.5℃以上の熱は、がん細胞のタンパク質変性、DNA切断、細胞膜破壊を引き起こし、細胞死を誘導する。
- 低酸素・酸性環境での効果増強: がん組織特有の低酸素・酸性環境(pH 6.5-6.7)下では、ハイパーサーミアの効果がより強力に発揮される。これは、酸素が豊富な領域で効果的な放射線治療と相補的な関係にあり、併用による治療効果の向上が期待される。
- 薬剤送達の改善: 加温により腫瘍内の血管透過性が亢進し、抗がん剤が血管外へ漏れ出しやすくなる。これにより、がん組織内の薬剤濃度が大幅に上昇し(1時間後で約2倍、3時間後で約3倍)、化学療法の効果を増強する。
- 転移の抑制: がん細胞が転移する過程で起こる形態変化「上皮間葉転換(EMT)」を抑制する作用が確認されている。これにより、血行性転移のリスクを低減させる可能性がある。
- がん免疫の増強: がん細胞を攻撃するキラーT細胞の腫瘍内への浸潤を促進するほか、がん細胞を守る制御性T細胞の働きを抑制するなど、多角的に抗がん免疫を活性化させる。
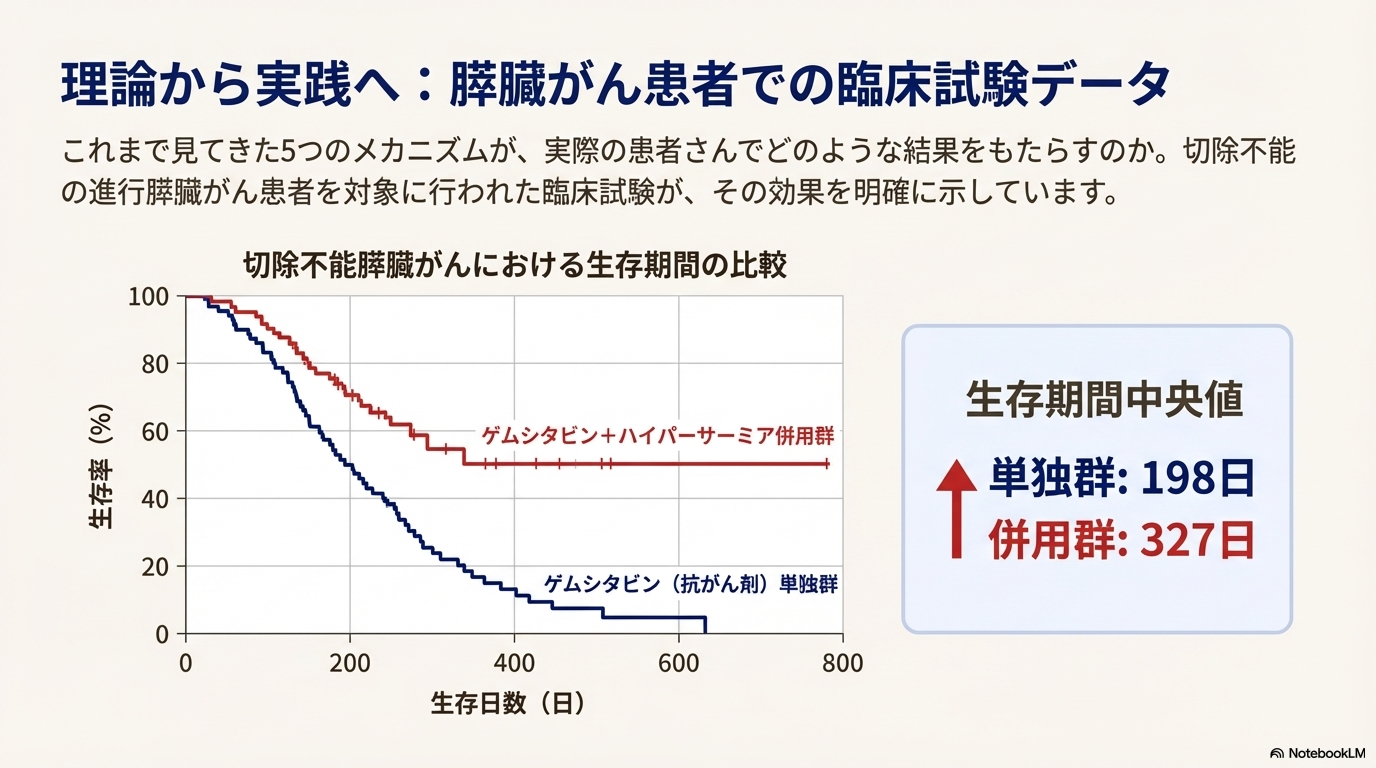
特に、膵臓がんは豊富なコラーゲン線維(間質成分)が物理的バリアとなり治療抵抗性を示すが、ハイパーサーミアは血管透過性を改善することでこのバリアの克服に寄与する。臨床試験では、切除不能膵臓がん患者において、化学療法(ゲムシタビン)にハイパーサーミアを併用することで、生存期間中央値が198日から327日へと有意に延長することが示されている。
現代のがん治療では、ハイパーサーミアを治療の最終手段とするのではなく、手術、化学療法、放射線療法といった標準治療と初期段階から組み合わせる「集学的治療」が治療成績を向上させる鍵であると結論づけられている。
——————————————————————————–
1. ハイパーサーミア治療の概要
ハイパーサーミアは、高周波を発生させる電極でがん組織を挟み込み、標的部位を選択的に加温する物理的ながん治療法である。
- 治療装置と方法: 装置はCTスキャナー程度の大きさで、上下に配置された電極間に患者が横たわる。高周波を照射することで、がん組織をターゲットに加温を行う。
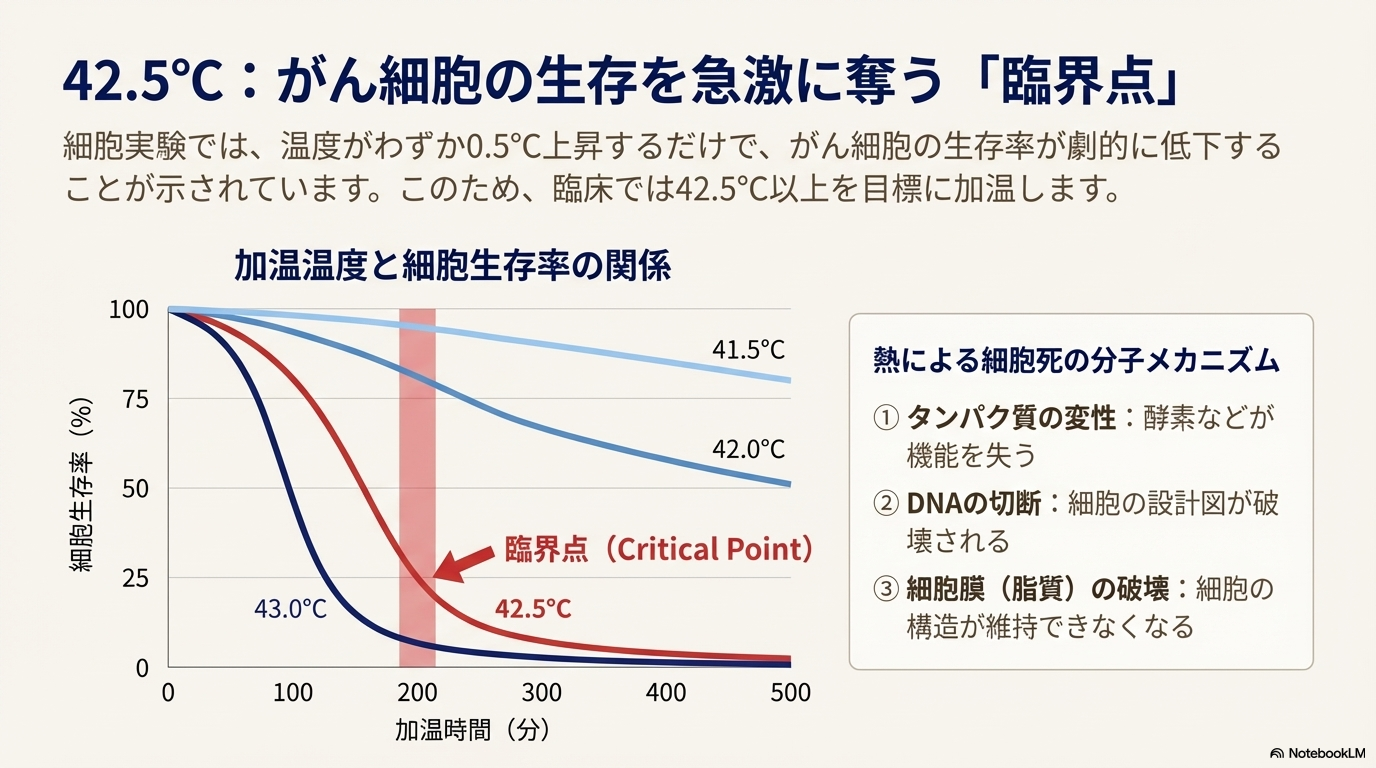
- 標的温度と効果の検証: 治療目標温度は42.5℃以上とされる。細胞実験において、42℃から42.5℃へわずか0.5℃温度が上昇するだけで、がん細胞の生存率が急激に低下することが確認されている。初期の臨床試験では、腫瘍内に直接針金状の温度計を挿入し、腫瘍内部が目標温度に達していることが実測で検証されていた。
2. がん治療におけるハイパーサーミアの5つの主要な作用機序
ハイパーサーミアの抗がん効果は、単なる熱による焼灼ではなく、複数の生物学的メカニズムに基づいている。
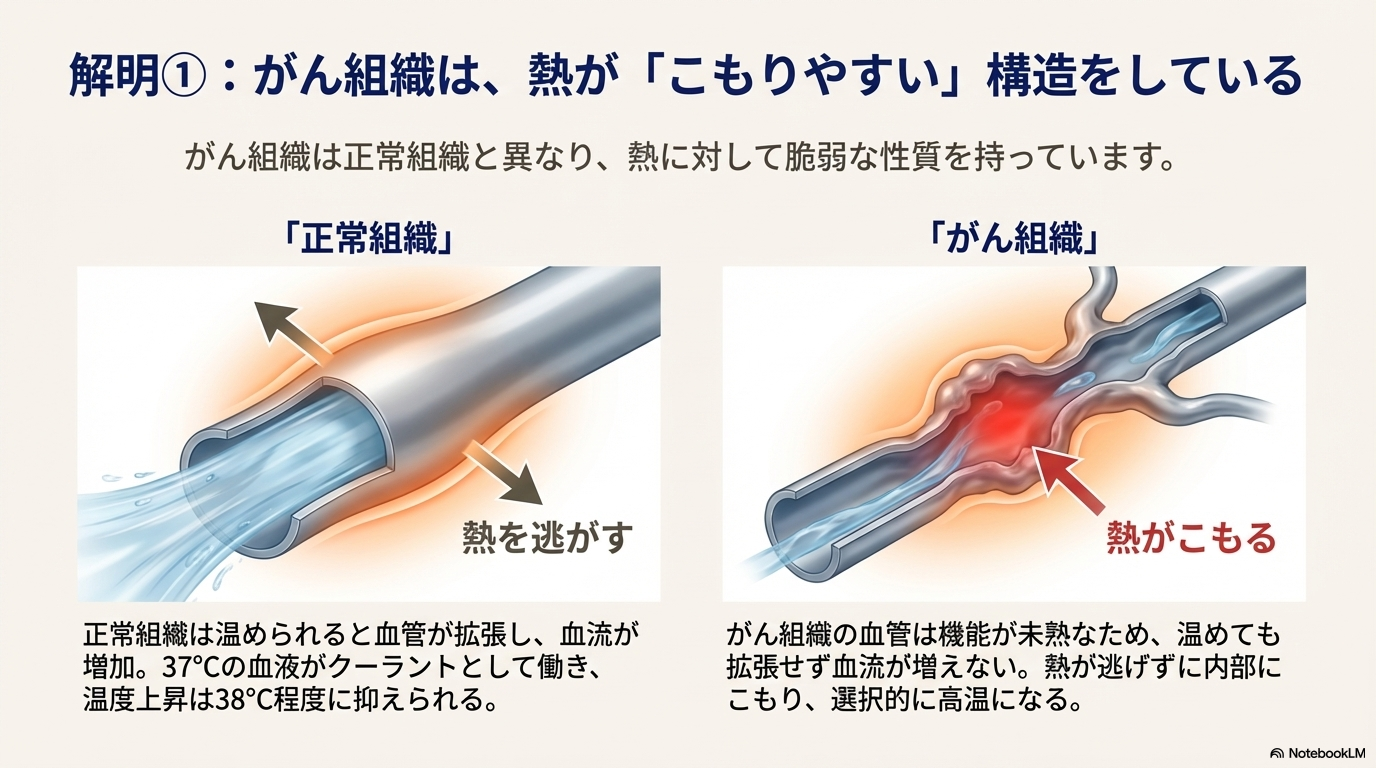
機序1:がん組織の熱に対する脆弱性
がん組織は、正常組織とは異なる生理学的特性を持つため、熱に対して脆弱である。
- 正常組織とがん組織の血流反応の違い:
- 正常組織: 加温されると血管が拡張し、血流が増加する。37℃の血液が循環することで熱が奪われ、組織の温度は上がりにくい(せいぜい38℃程度)。
- がん組織: 腫瘍内の血管は急造された脆弱な構造のため、加温されても血管が拡張せず、血流が増加しない。これにより熱が組織内にこもりやすく、選択的に高温状態(42.5℃〜43℃)に達する。
- 細胞レベルでの致死効果: 42.5℃程度の熱でも、がん細胞内の分子に以下のような不可逆的なダメージを与える。
- タンパク質変性: 細胞機能に必須な酵素などのタンパク質が変性し、機能を失う。
- DNA切断: 遺伝情報を持つDNAが熱によって切断され、細胞死に至る。
- 脂質膜の損傷: 細胞膜を構成する脂質が熱変性を起こし、細胞膜の構造が維持できなくなる。
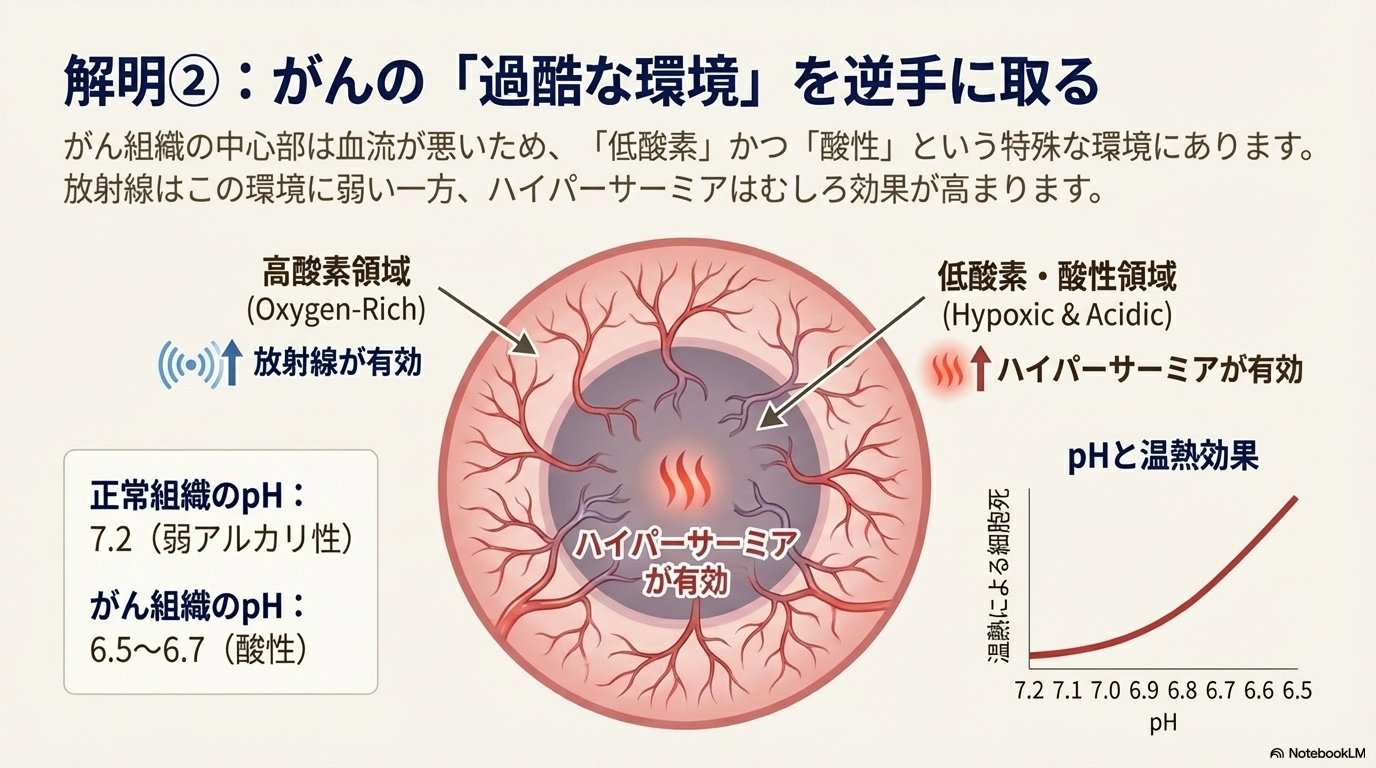
機序2:低酸素・酸性環境下での効果増強
がん組織の微小環境は、ハイパーサーミアの効果を増強する上で有利に働く。
- がん組織の特異的な微小環境: がん組織は血流が乏しいため、低酸素状態にあり、代謝の結果として酸性に傾いている(pH 6.5〜6.7)。正常組織のpH(約7.2)と比較して、この酸性環境ががん細胞を熱に対してさらに脆弱にすることが細胞実験で証明されている。
- 放射線治療との相補性:
- ハイパーサーミア: 低酸素・酸性領域で効果が高い。
- 放射線治療: 酸素が豊富な領域(高酸素領域)で効果が高い。
- 両者を併用することで、腫瘍内の異なる環境に存在するがん細胞をそれぞれ攻撃でき、相乗的な治療効果が期待できる。
機序3:血管透過性の亢進と薬剤送達の改善
ハイパーサーミアは、化学療法の効果を直接的に増強する作用を持つ。
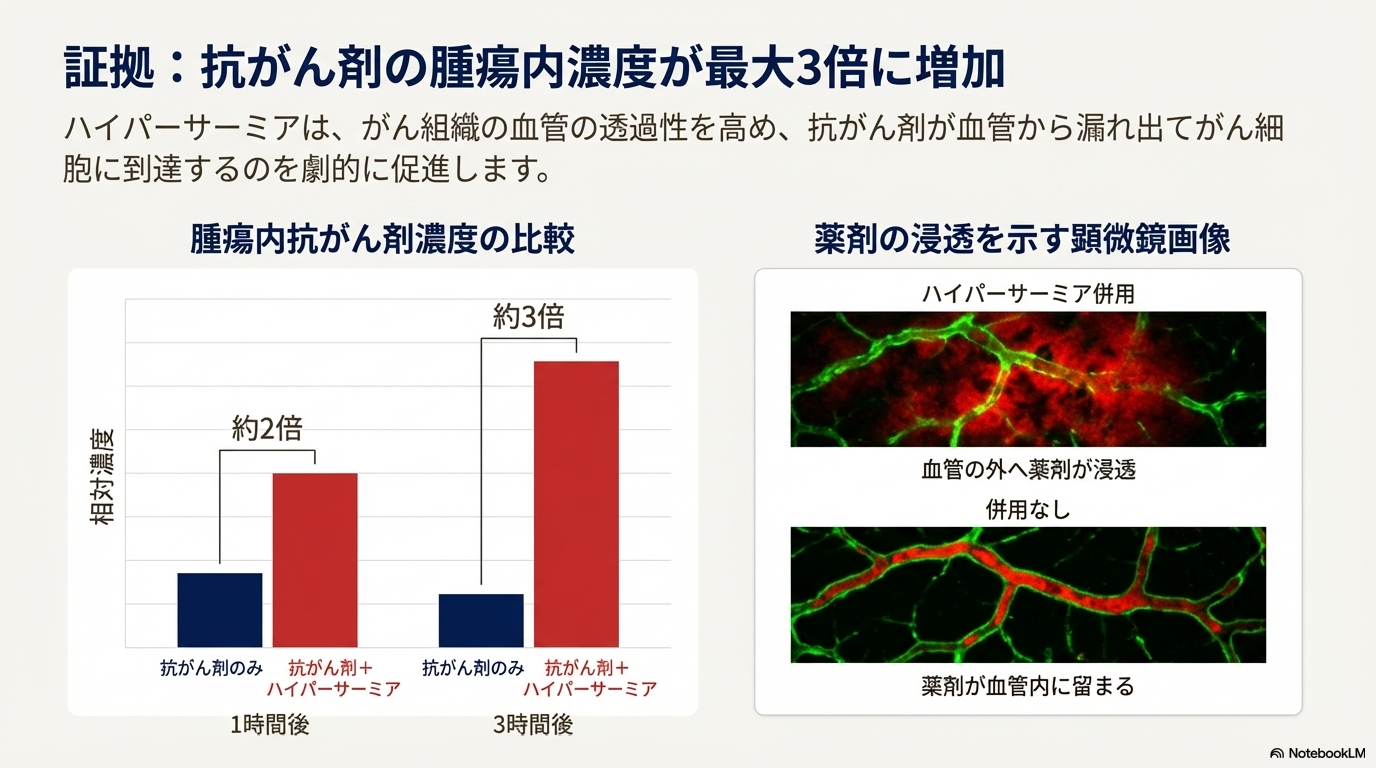
- 抗がん剤の腫瘍内濃度上昇: 加温により、がん組織内の血管の壁の透過性(血管透過性)が亢進する。これにより、血中を流れる抗がん剤が血管の外へ漏れ出し、がん細胞へ到達する量が増加する。
- 実験データによる裏付け: 膵臓がん細胞を移植したマウスを用いた実験では、抗がん剤投与時にハイパーサーミアを併用した群は、併用しなかった群と比較して、腫瘍内の抗がん剤濃度が有意に高かった。
| 経過時間 | 腫瘍内抗がん剤濃度(ハイパーサーミア併用時) |
| 1時間後 | 約2倍 |
| 3時間後 | 約3倍 |
このデータは、ハイパーサーミアと化学療法の併用が論理的に不可欠であることを示唆している。
機序4:上皮間葉転換(EMT)の抑制による転移予防
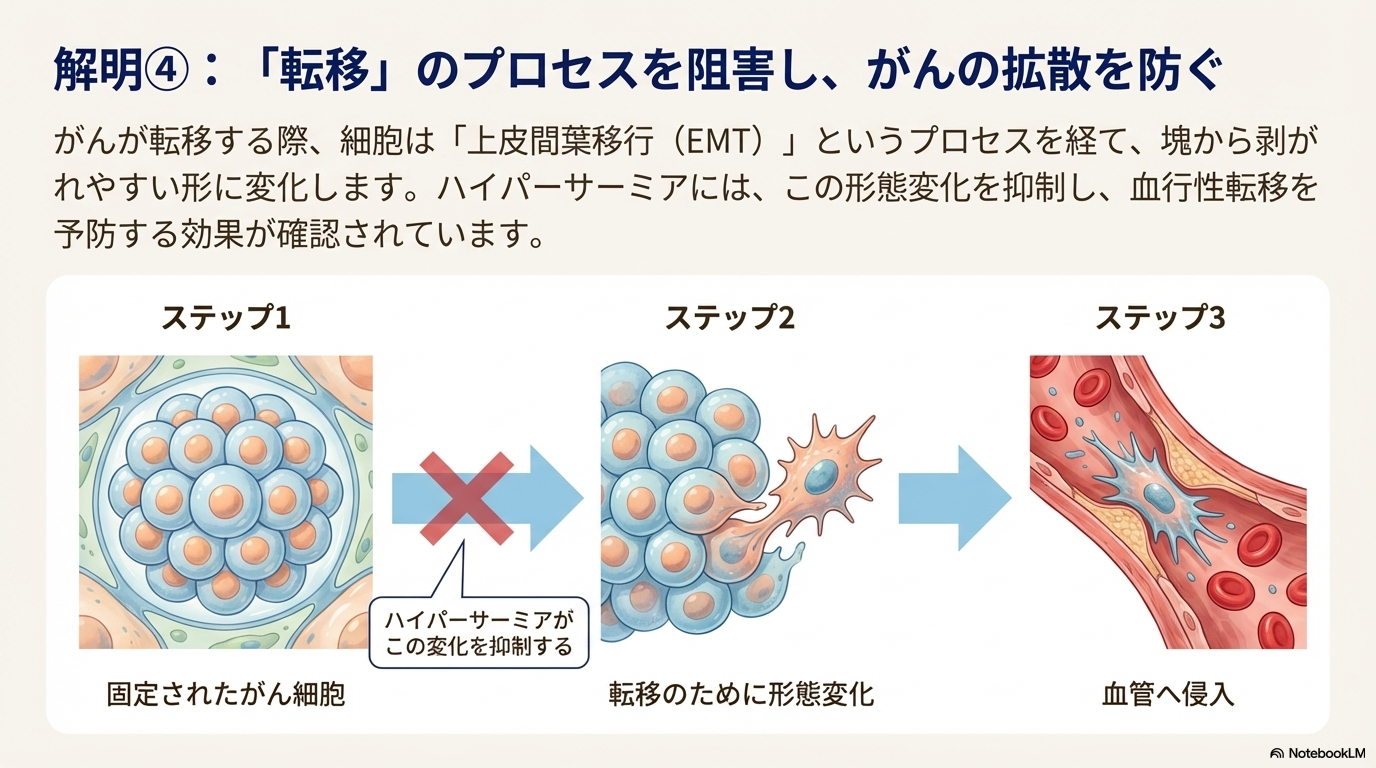
ハイパーサーミアは、がんの遠隔転移プロセスを阻害する可能性が示されている。
- 転移プロセスにおけるEMTの役割: がん細胞は、原発巣から離れて血流に乗り、他の臓器へ転移する際に、「上皮間葉転換(EMT)」と呼ばれるプロセスを経て、運動能力の高い形態に変化する。
- ハイパーサーミアによるEMT抑制: 実験により、ハイパーサーミアがこのEMTプロセスを抑制し、がん細胞が転移能力を獲得するのを防ぐことが確認されている。特に、抗がん剤(ゲムシタビンなど)が副作用としてEMTを誘導する場合があるが、ハイパーサーミアを併用することでその作用を打ち消し、転移を抑制する効果が期待できる。
機序5:がん免疫の増強
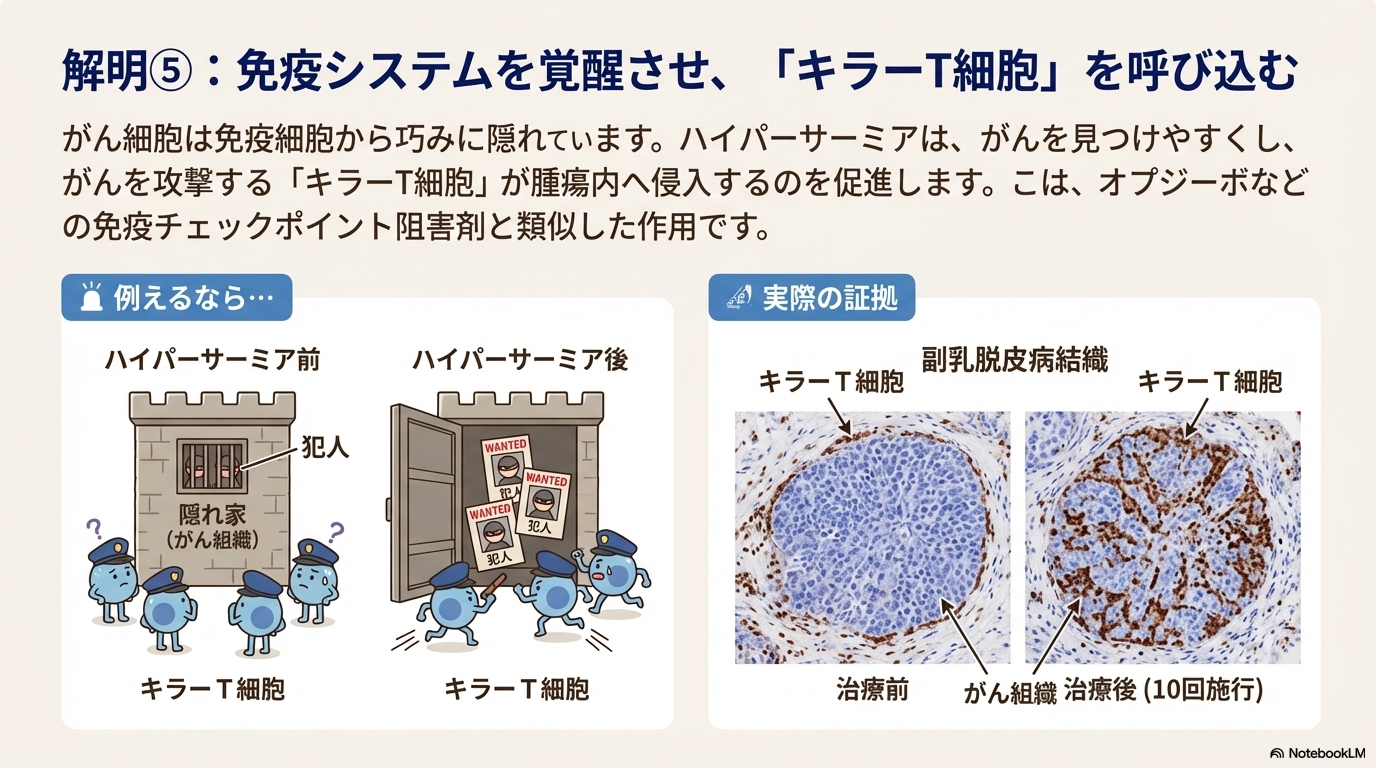
ハイパーサーミアは、免疫チェックポイント阻害剤(オプジーボなど)と同様に、患者自身の免疫システムを活性化してがんと戦わせる作用を持つ。
- キラーT細胞の腫瘍内浸潤促進: がん細胞を直接攻撃するリンパ球である「キラーT細胞」が、腫瘍組織内へ侵入(浸潤)するのを促進する。これにより、免疫細胞ががん細胞を効率的に排除できるようになる。
- その他の免疫学的効果:
- がん細胞表面の「がん抗原」の発現を高め、免疫細胞ががんを認識しやすくする。
- がん細胞自身が分泌する増殖促進物質(サイトカイン)の産生を抑制する。
- がん細胞を免疫攻撃から守る「制御性T細胞(Treg)」の働きを抑制する。
3. 膵臓がん治療におけるハイパーサーミアの重要性
膵臓がんは固形がんの中でも予後が極めて悪い難治がんとされるが、ハイパーサーミアはその治療において特有の価値を持つ。2018年の調査では、ハイパーサーミア治療を受けるがん種の中で膵臓がんが最も多いことが示されており、標準治療の困難さを反映している。
膵臓がんの治療抵抗性の原因
- 早期発見の困難性: 発見時にはすでに進行しており、手術可能な患者は20%以下と非常に少ない。
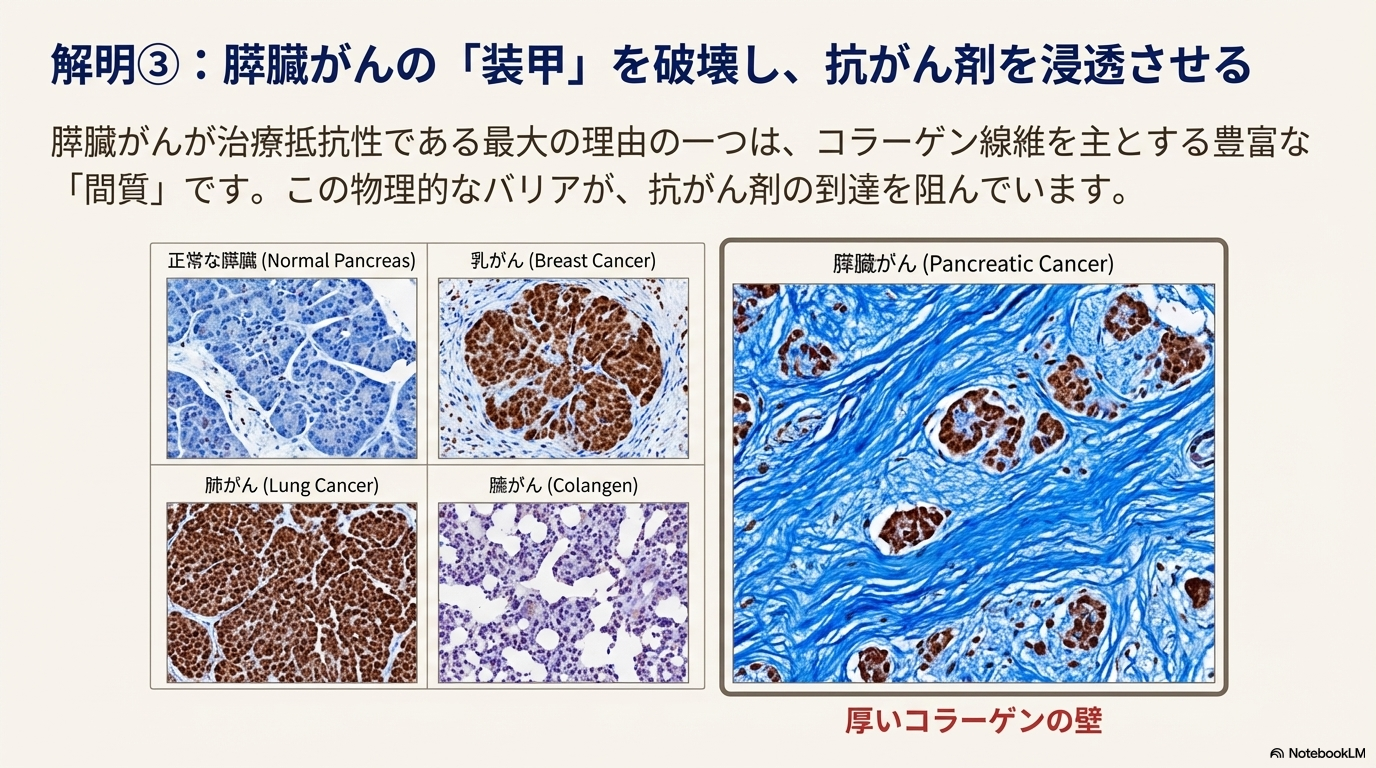
- 間質成分(コラーゲン)による物理的バリア: 膵臓がん組織は、コラーゲン線維を主成分とする間質が異常に豊富である。この密なコラーゲン層が物理的な壁となり、抗がん剤や放射線ががん細胞に到達するのを妨げている。
ハイパーサーミアによる治療抵抗性の克服
ハイパーサーミアは、加温によって腫瘍内の血管透過性を改善する。これにより、コラーゲンバリアを乗り越えて抗がん剤ががん細胞へ浸透しやすくなり、化学療法の効果を高めることで治療抵抗性を克服する一助となる。
4. 臨床データと治療成績
ハイパーサーミアの併用は、膵臓がん患者の治療成績を明確に改善することが臨床データで示されている。
生存期間の延長
切除不能膵臓がん患者を対象とした臨床試験において、化学療法(ゲムシタビン)単独群とハイパーサーミア併用群を比較した結果、生存期間に有意な差が見られた。
| 治療法 | 生存期間中央値(50%生存日数) |
| ゲムシタビン単独 | 198日 |
| ゲムシタビン + ハイパーサーミア併用 | 327日 |
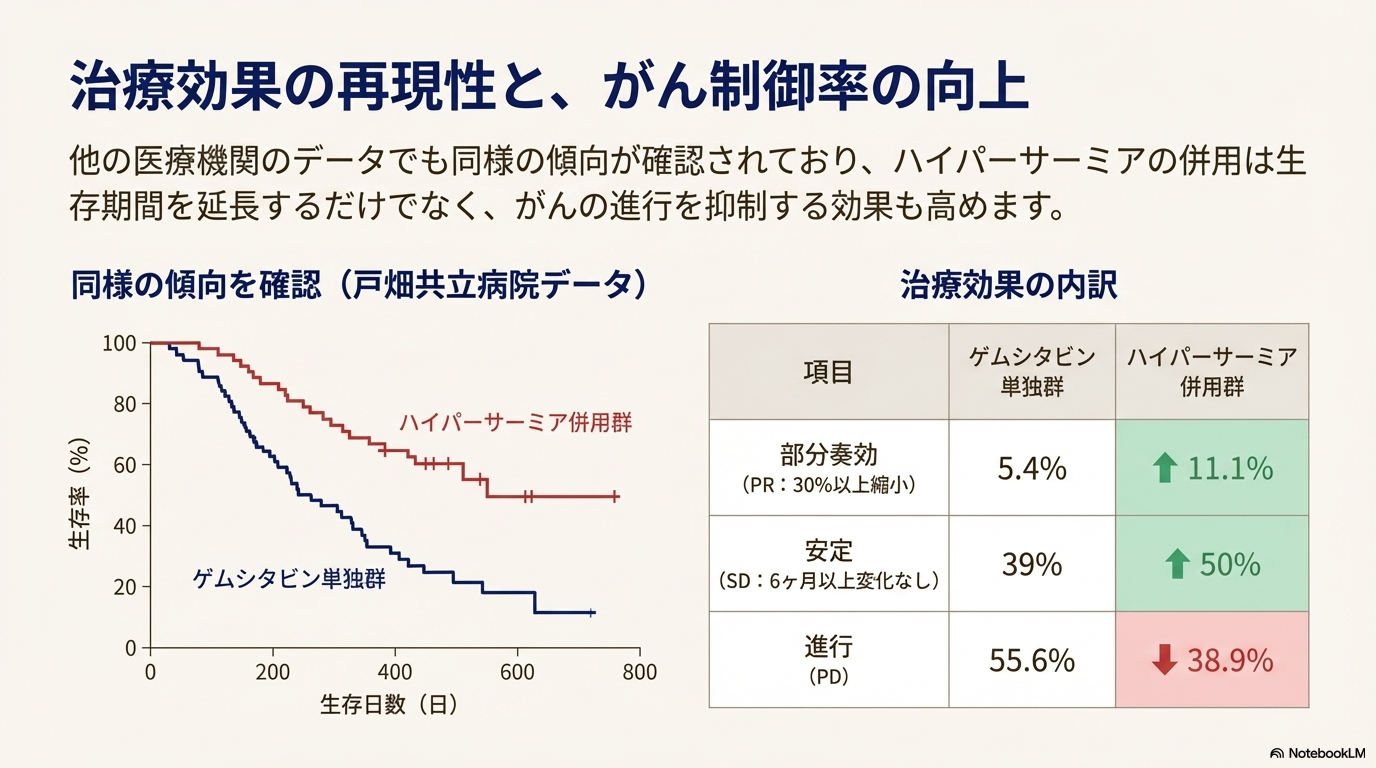
奏効率と病勢コントロール率の改善
ゲムシタビン治療におけるハイパーサーミア併用の有無による治療効果の比較データ。
| 評価項目 | ゲムシタビン単独 | ゲムシタビン + ハイパーサーミア併用 |
| 部分奏功(PR: 30%以上縮小) | 5.4% | 11.1% |
| 安定(SD: 6ヶ月以上変化なし) | 39.0% | 50.0% |
| 進行(PD: 増大) | 55.6% | 38.9% |
ハイパーサーミア併用群では、腫瘍が縮小または安定する割合が高く、進行する割合が低いことが示されている。
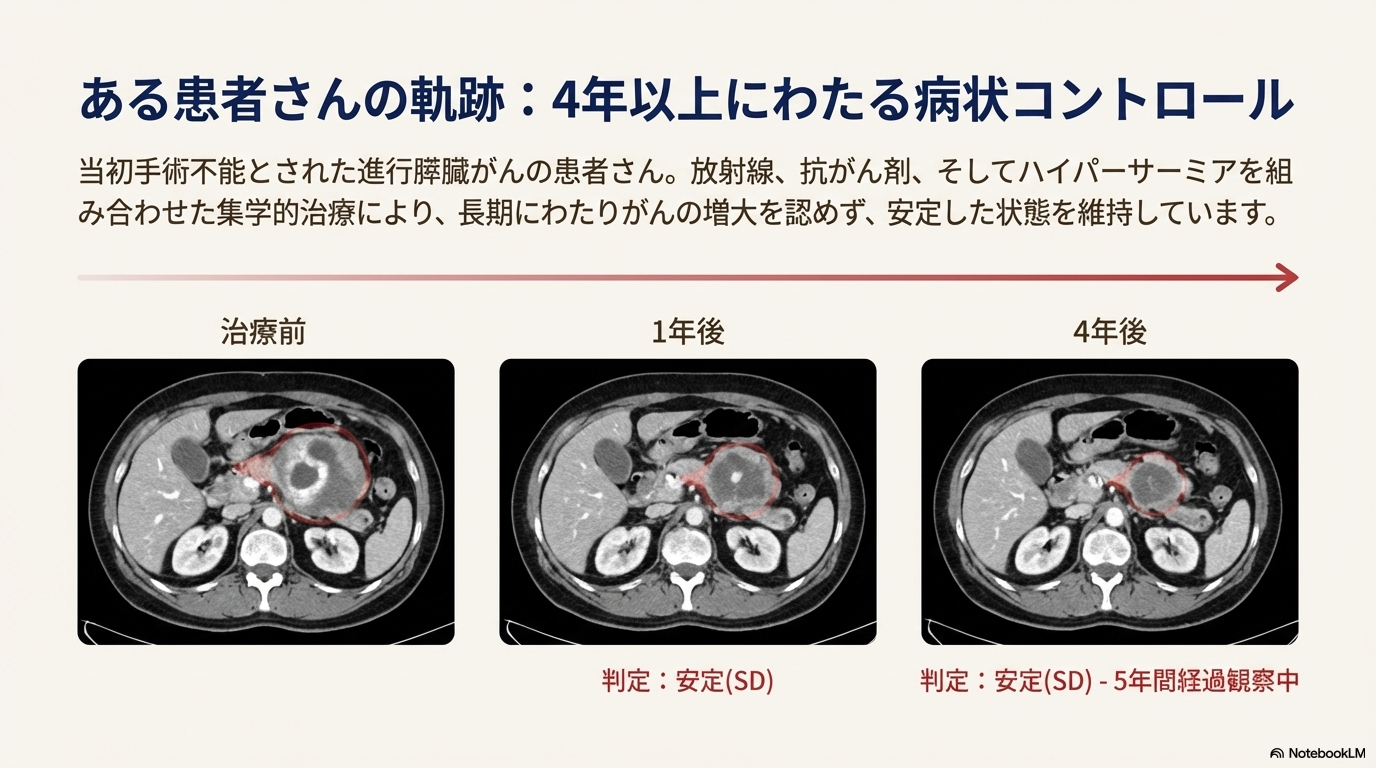
症例報告
- 症例1: 進行膵臓がんで手術不能だったが、放射線、抗がん剤、ハイパーサーミアを併用。4年後も腫瘍の増大は認められず、5年間経過観察中である。
- 症例2: 膵尾部に大きな腫瘍があり、肝転移も認めたが、抗がん剤とハイパーサーミアを併用。2年後、肝転移巣はほぼ消失し、原発巣も縮小して胃壁との距離が確保された状態で生存中である。
5. 現代のがん治療におけるハイパーサーミアの位置づけ
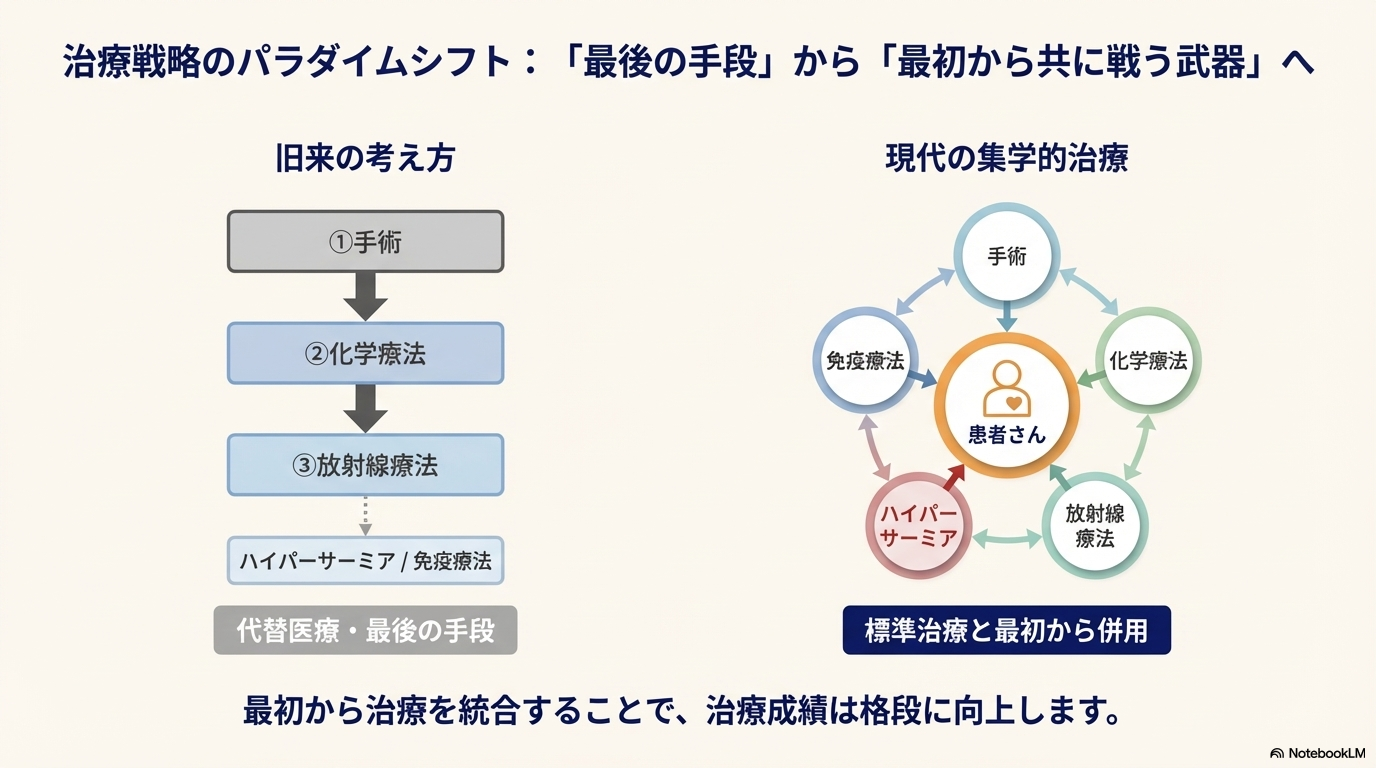
ハイパーサーミアの治療戦略における位置づけは、時代とともに変化している。
- 古典的アプローチ(旧来): 手術、化学療法、放射線といった標準治療が効かなくなった後の「最後の手段」として位置づけられていた。
- 現代的アプローチ(集学的治療): 標準治療を開始する初期段階からハイパーサーミアや免疫療法を積極的に組み合わせる。このアプローチにより、治療成績が格段に向上することが示唆されており、現在ではこの集学的治療が推奨されている。
6. 実践的情報:保険適用と注意点
保険適用の範囲と制限
ハイパーサーミアは1996年から公的医療保険の適用対象となっている。
| 項目 | 詳細 |
| 適用範囲 | 単独治療、放射線併用、化学療法併用のすべてが対象。 |
| 適用期間 | 2ヶ月間治療を行い、その後1ヶ月休薬する3ヶ月を1サイクルとする。このサイクルを最大3回まで繰り返すことが可能(年間最大6ヶ月間)。 |
| 治療頻度 | 通常、週1回。1回あたりの加温時間は40分〜60分。 |
治療対象外となるケース
以下の場合は、ハイパーサーミア治療を受けることができない。
- 対象部位: 脳腫瘍、眼球腫瘍(頭蓋骨や解剖学的問題のため)
- 禁忌事項:
- 心臓ペースメーカーを装着している患者(高周波が悪影響を及ぼすため)。
- 体内に金属(人工関節など)があり、加温に影響を及ぼす可能性がある場合。