臨床試験(治験)の探し方(3)
臨床試験の段階
新薬の臨床試験(治験)は次の段階を経て行なわれます。
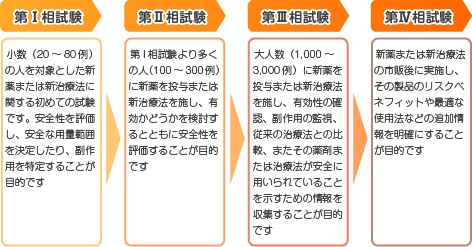
通常は第Ⅲ相試験の後に新薬として承認されます。私たちが参加できるのは、主としてⅠからⅢ相試験です。
 臨床試験への参加を検討する際の一助となる書籍(Kindle版です)が出版されています。
臨床試験への参加を検討する際の一助となる書籍(Kindle版です)が出版されています。
本書は米国国立がん研究所(NCI)の解説書をもとに、勝俣倫之医師らの協力のもと、日本の患者・家族向けに再編集されたものです。
気になる参加のメリット・デメリット、臨床試験の仕組みや種類、試験の探し方、参加方法、費用など、よりよい選択のために必要な情報をわかりやすく解説しています。
また、臨床試験に関する基本的な知識は、がん情報センターの「臨床試験について」も参考になります。

これらの内容に補足しておきます。
費用について
臨床試験なのだから無料で受けられると思っているとがっかりします。多くの場合費用負担は次のようになっています。
臨床試験(治験)の種類や医療機関によって、どこまで自己負担になるかが異なります。 一般的に、新薬承認のための「治験」では、試験参加中に投与された抗がん剤の費用、検査費用は治験実施者(製薬会社など)が負担します。再診料や副作用を緩和するための薬代などが自己負担となります(健康保険が適用される)。
臨床試験参加中は参加者の金銭面での負担(交通費など)を軽減する目的で、「負担軽減費」が支払われます。支払われる金額はその都度異なりますが、一般的には1回の通院に7000円程度といわれています。
プラセボの対象になる可能性
第Ⅲ相試験(ときに第Ⅱ相試験)では、プラセボ対照試験が行なわれます。しかし、人道上の見地から、がん治療の試験でプラセボのみの試験グループが設定されることはほとんどありません。プラセボ(偽薬)とは、試験薬と見た目は同じでも、有効成分を含んでいない偽の薬です。がん治療の試験では、標準治療薬に新薬またはプラセボを追加して両グループを比較することが多いです。膵臓がんの場合では、GEM+アブラキサン+新薬、またはGEM+アブラキサン+プラセボとなるでしょう。
第Ⅰ相試験では有効でないことが多いのでは?
第Ⅰ相試験は「有効性の検証」が主目的であり、標準治療が無効となった患者さんが、人の助けとなることをしたい、せめてがん研究に貢献したいとの思いで参加することが多いようです。
しかし近年では、分子標的薬の開発が進み、治療が奏効するとみられる患者さんを特定するための遺伝子(バイオマーカー)検査も発達しています。第Ⅰ相臨床試験においても、これまでよりも大きなメリットが期待できるようになりつつあります。
先日報じられた東京大学の医学系、生命科学系での研究論文不正疑惑のように、日本の臨床試験を巡る環境は、まだまだダーティな部分が多いようです。
製薬企業から教授たちへの資金提供の隠れ蓑として、臨床試験が立ち上げられるとの噂も絶えません。こんな臨床試験に参加させられた患者は堪ったものではありませんね。主治医に確認するなど、慎重に調査しましょう。
日本版コンパッショネートユース(CU)制度
今年1月から「人道的見地からの拡大治験」という制度が始まりました。いわゆる「日本版コンパッショネートユース(CU)制度」です。
人道的見地から実施される治験(拡大治験)は、「原則として、当該医薬品の承認申請、承認及び保険適用の期間を待つことが出来ない、生命に重大な影響がある疾患であって、既存の治療法に有効なものが存在しない疾患の治験薬を対象とする。」とされています。また、その実施については、あくまでも主たる治験の実施に影響を及ぼさないことを前提とすること、法的義務ではなく、その実施の可否は、当該治験薬を提供する者等が決定するものであることとされています。
「膵臓がんにCU制度を導入 15年度から」で紹介してから3年。製薬企業に義務付をしなかった結果、がん患者から見た内容は不満足なものになっています。
「独立行政法人 医薬品医療機器統合機構」の「治験情報の公開」に募集内容がアップされていますが、半年以上経った8月31日現在で、がん関係はファイザー社のROS1陽性の非小細胞肺癌の1件だけ。お寒いかぎりです。
 臨床試験の「治療開発マップ」も参考になります。
臨床試験の「治療開発マップ」も参考になります。
(完)