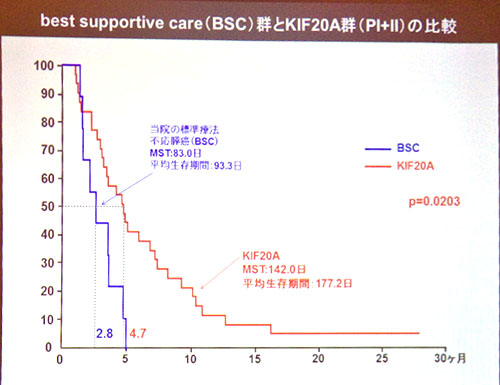
アブラキサンの第3相試験:FDA
昨年12月に開催された、パンキャン主催の「膵がん勉強会 X’mas スペシャル 2012」において、杏林大学・古瀬純司先生が「FOLFIRINOXもまもなく国内での安全性確認の臨床試験が終わり、近々承認されるでしょう。アブラキサンも既に国内での臨床試験が始まっています。」と講演されましたが、それから1年が経とうとしています。ドラッグラグ解消が進んでいると厚生労働省は言うのですが、返って悪くなっているのではないかという気もします。
FOLFIRINOXは近々、転移性膵癌への保険適用になりそうです。しかし、あの地獄を見るような副作用では、対象となる患者は、身体状態の良い、若くて元気な患者、PS0(無症状で社会活動ができ、制限を受けることなく、発症前と同様に振舞える)、PS1(軽度の症状があり、肉体労働は制限を受けるが、歩行、軽労働、座業はできる。例えば軽い家事、事務など)の患者に限られるのでしょう。つまり、膵臓がんのステージⅣbで、腫瘍が遠隔転移しているが、外見上は正常な人と同じ患者が対象となるはずです。そしてFOLFIRINOXの投与を受けたとたんに重症患者になってしまうのでしょう。
FDAは9月に、転移性膵癌の第3相試験「MPACT」の結果を受け、ゲムシタビンとの併用でアブラキサンを転移性膵癌治療薬の第一選択薬として承認しました。MPACT試験の結果はASCO2013でも発表されていますが、査読済み論文としてニューイングランド・ジャーナル・オブ・メディシン10月16日号オンライン版に掲載されています。
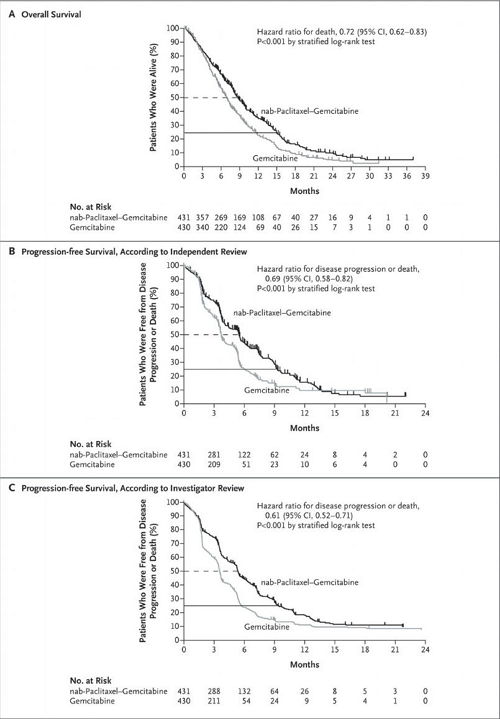
アブラキサンとゲムシタビンの併用療法を受けた患者はゲムシタビンの単剤療法を受けた患者と比べ、全生存期間で統計的に有意な改善を示すことが実証されました。(中央値が8.5カ月対6.7カ月、HR 0.72、p<0.0001)
アブラキサンとゲムシタビンの併用療法を受けた患者ほど(61%)、ゲムシタビン単独の患者と比べ(44%)、CA19-9の少なくとも20%低減を達成しました(p<0.0001)。治療開始8週までにCA19-9の20%低減を達成した患者における生存期間のランドマーク解析では、アブラキサンとゲムシタビンの併用療法を受けCA19-9反応を示した患者が、ゲムシタビン単独の患者と比べ、生存期間の有意な改善を示しました。(それぞれ13.2カ月と9.4カ月)(p<0.0001)
ASCO 2010では、アブラキサンとゲムシタビンの併用療法に結果、ダウンステージして手術が可能になった患者が23%いたと発表されたのですが、今回の試験結果ではそれらしき患者に触れていません。3年後には全員亡くなっています。
日本において保険で使える膵臓がんの薬はゲムシタビン、TS-1、タルセバの3種類ですが、タルセバとFOLFIRINOXは使える患者が制限されます。アブラキサンの早期承認が待たれるところです。
27日(日)にパンキャンの主催の『すい臓がん啓発パープルリボンセミナー2013 in 東京』でもこうした最新の話題が紹介されるのでしょう。